-
 Neuer Ausschuss der Ärztekammer stellt sich vor
Neuer Ausschuss der Ärztekammer stellt sich vorInnovation, Technologie und Digitalisierung
-
 Sachsen-Anhalt geht neue Wege in der Weiterbildung von Notärzten
Sachsen-Anhalt geht neue Wege in der Weiterbildung von NotärztenNotarztsimulationskurse
-
-

-

Innovation, Technologie und Digitalisierung
-

Notarztsimulationskurse
-
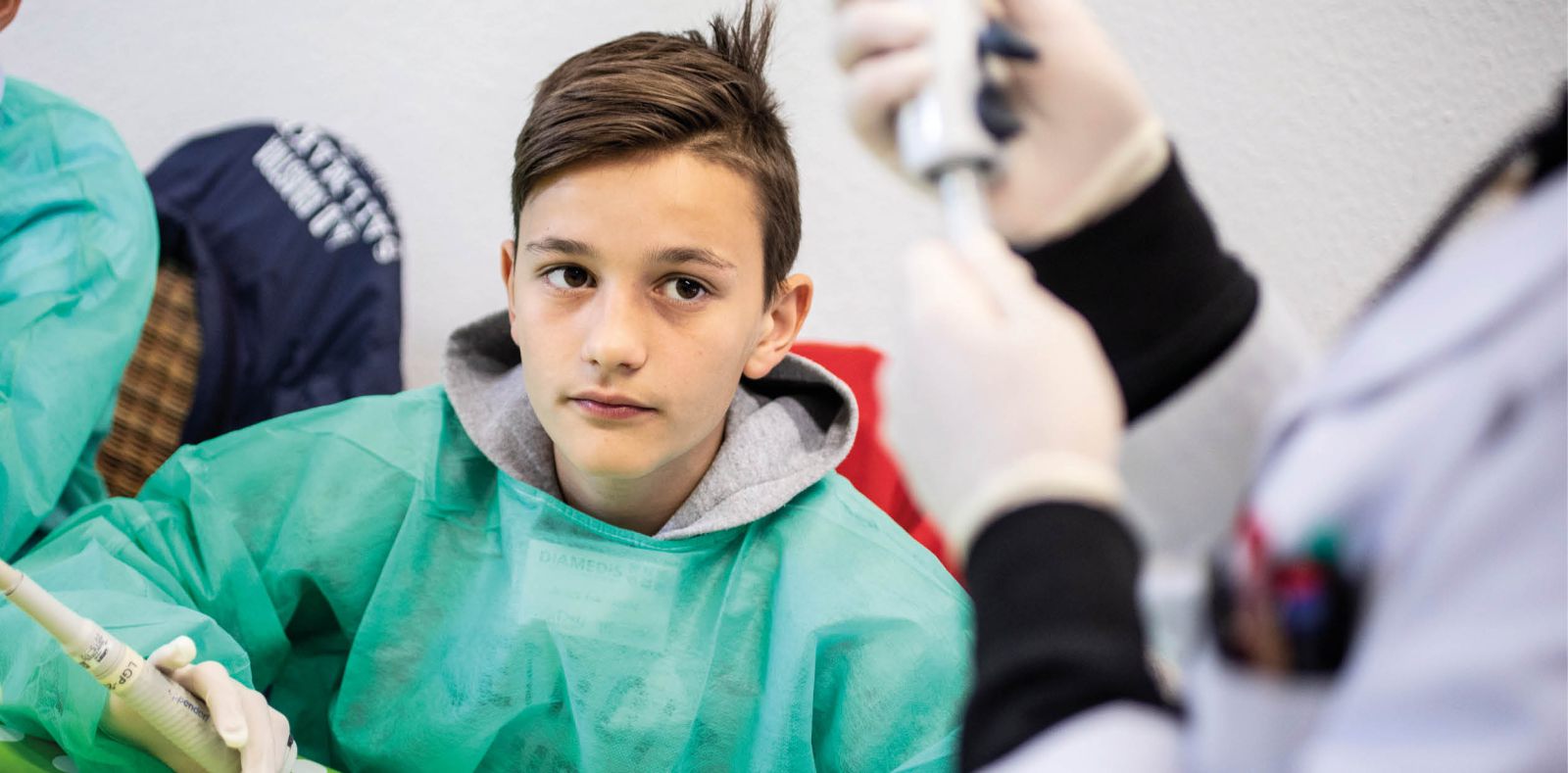
Raus aus der Schule & rein in die Medizin
-

Aneurysma der Vena jugularis interna


Dr. med. Torsten Kudela
Vorstandsmitglied der Ärztekammer Sachsen-Anhalt
(Foto: Peter Gercke)
Es müssen nun endlich Taten folgen
Im Februar gab es einen neuen Tarifabschluss zwischen dem Verband medizinischer Fachberufe e. V. und der Arbeitsgemeinschaft zur Regelung der Arbeitsbedingungen der Arzthelferinnen/ Medizinischen Fachangestellten. Im Durchschnitt ergibt sich daraus eine Lohnerhöhung um 7,4 Prozent. Insbesondere die Berufseinsteiger und Auszubildenden profitieren deutlich von den Steigerungen. Der neue Tarifabschluss kann nur begrüßt werden, gerade im Hinblick auf die gestiegenen Lebenshaltungskosten und die Tarifabschlüsse in den anderen Branchen. Ohne die Arbeit und den Einsatz unserer Mitarbeiter wäre das tägliche Pensum nicht zu bewältigen und die Versorgung auf dem derzeitigen Niveau nicht zu halten. Ein Abwandern der MFA aus unseren Praxen muss daher verhindert werden. Wahrheitsgemäß wird die ambulante medizinische Versorgung der Bevölkerung als sozialer Kit der Gesellschaft bezeichnet. Jedoch darf dabei nicht vergessen werden, dass die Gehaltssteigerungen und auch Sonderzahlungen endlich komplett gegenfinanziert werden müssen. Eine Vereinbarung, dass tariflich bedingt steigende Personalkosten ab 2025 direkt bei den Honorarverhandlungen berücksichtigt werden, wurde 2023 vom GKV-Spitzenverband und KBV getroffen. An der Umsetzung werden wir den GKV-Spitzenverband messen.
Es müssen nun endlich Taten folgen
Im Februar gab es einen neuen Tarifabschluss zwischen dem Verband medizinischer Fachberufe e. V. und der Arbeitsgemeinschaft zur Regelung der Arbeitsbedingungen der Arzthelferinnen/ Medizinischen Fachangestellten. Im Durchschnitt ergibt sich daraus eine Lohnerhöhung um 7,4 Prozent. Insbesondere die Berufseinsteiger und Auszubildenden profitieren deutlich von den Steigerungen. Der neue Tarifabschluss kann nur begrüßt werden, gerade im Hinblick auf die gestiegenen Lebenshaltungskosten und die Tarifabschlüsse in den anderen Branchen. Ohne die Arbeit und den Einsatz unserer Mitarbeiter wäre das tägliche Pensum nicht zu bewältigen und die Versorgung auf dem derzeitigen Niveau nicht zu halten. Ein Abwandern der MFA aus unseren Praxen muss daher verhindert werden. Wahrheitsgemäß wird die ambulante medizinische Versorgung der Bevölkerung als sozialer Kit der Gesellschaft bezeichnet. Jedoch darf dabei nicht vergessen werden, dass die Gehaltssteigerungen und auch Sonderzahlungen endlich komplett gegenfinanziert werden müssen. Eine Vereinbarung, dass tariflich bedingt steigende Personalkosten ab 2025 direkt bei den Honorarverhandlungen berücksichtigt werden, wurde 2023 vom GKV-Spitzenverband und KBV getroffen. An der Umsetzung werden wir den GKV-Spitzenverband messen.

(Foto: Peter Gercke)
Alle aktuellen Beiträge aus der Medizin und Mitteilungen der Ärztekammer Sachsen-Anhalt.

Fokus Medizin
-
ÄB 04/2024
Aneurysma der Vena jugularis interna
Fallbericht einer seltenen Entität – Ein Aneurysma ist eine lokale Aussackung eines Blutgefäßes, die sich aufgrund einer Schwächung oder Schädigung der Gefäßwand entwickelt. -
ÄB 03/2024
Posttraumatisches Pseudoaneurysma der A. brachialis dextra bei Z. n. Humerus-fraktur mit geschlossener Reposition und Drahtspickung bei einem Kind
Pseudoaneurysmen sind eine mögliche und durchaus bekannte als auch gefürchtete Komplikation bei Arterienwandalteration der oberen und unteren Extremität wie z. B. durch Traumata diverser Genese und Schädigungsmechanismen (Druck, Kompression, Dehnung, Schnittverletzung, Fraktur, iatrogen etc.).
-
ÄB 0102/2024
Populationsbasierte Kohortenstudie für digitale Gesundheitsforschung in Deutschland
DigiHero ist eine bevölkerungsbasierte prospektive Kohortenstudie zur Erforschung chronischer Krankheiten und gesunden Alterns (Ethikkommission der Medizinischen Fakultät der Martin-Luther-Universität Halle-Wittenberg Nr. 2020-076; DRKS-Registrierungs-ID: DRKS00025600).
-
ÄB 12/2023
CAR-T-Zellen in der Behandlung von Patienten mit Lymphomen und Multiplem Myelom
Die CAR-T-Zell-Therapie ist eine innovative und vielversprechende Immuntherapie, die auf gentechnisch veränderten T-Zellen mit synthetischen, chimären Antigenrezeptoren („CAR“s) basiert.
-
ÄB 11/2023
Ein Plädoyer für „inkrementelle“ Wissenschaft
Disruptive Forschung kommt öffentlich mit einem lauten Knall daher. Sie wirkt beeindruckend, erfolgreich. Dabei leistet gerade die Forschung in kleinen Schritten, die inkrementelle Forschung, Antworten auf viele gesellschaftlich drängende Fragen.
-
ÄB 10/2023
Der Mensch im Mittelpunkt einer sich wandelnden Arbeitskultur in der Medizin
Gesellschaftlich stehen Bereiche mit einem hohen sozialen Engagement, Bil-dung, Lehre und Wissenschaft, wie die Medizin, vor einem Wandel. Die medizinische Versorgung ist vor allem aus Sicht gesetzlich Versicherter in den letzten Jahren spürbar schlechter geworden.
-
ÄB 09/2023
Früherkennung und Intervention bei erhöhtem Psychoserisiko
Etwa 3,5 Prozent aller Menschen er- kranken im Laufe ihres Lebens an psychotischen Störungen (1). Verbun-den mit einer hohen Krankheitslast zählen Psychosen zu den kostenintensivsten Erkrankungen pro Person. -
ÄB 09/2023
CIRS-Fall
In regelmäßiger Folge möchte der Ausschuss Qualitätssicherung im Ärzteblatt Sachsen-Anhalt auf sicherheitsrelevante Ereignisse hinweisen, die dem interprofessionellen und interdisziplinären Lernen dienen. -
ÄB 0708/2023
Long-Covid und Post-Covid-Syndrom
Die Covid-19-Pandemie stellt Gesundheitssysteme weltweit seit Ende Dezember 2019 vor große Herausforderungen.
-
ÄB 06/2023
Sondenextraktion kardialer Schrittmacher- und Defibrillatorsonden
Die Implantation von kardialen Schrittmacher- und Defibrillatorsystemen hat sich in den letzten 30 Jahren (...) entwickelt.