[1] Cribier A, Eltchaninoff H, Bash A, Borenstein N, Tron C, Bauer F et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation 2002;106(24):3006–8. https://doi.org/10.1161/01.cir.0000047200.36165.b8.
[2] Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2022;43(7):561–632. https://doi.org/10.1093/eurheartj/ehab395.
[3] Forrest JK, Deeb GM, Yakubov SJ, Gada H, Mumtaz MA, Ramlawi B et al. 4-Year Outcomes of Patients With Aortic Stenosis in the Evolut Low Risk Trial. J Am Coll Cardiol 2023;82(22):2163–5. https://doi.org/10.1016/j.jacc.2023.09.813.
[4] Mack MJ, Leon MB, Thourani VH, Pibarot P, Hahn RT, Genereux P et al. Transcatheter Aortic-Valve Replacement in Low-Risk Patients at Five Years. N Engl J Med 2023.
[5] van Mieghem NM, Deeb GM, Søndergaard L, Grube E, Windecker S, Gada H et al. Self-expanding Transcatheter vs Surgical Aortic Valve Replacement in Intermediate-Risk Patients: 5-Year Outcomes of the SURTAVI Randomized Clinical Trial. JAMA Cardiol 2022;7(10):1000–8. https://doi.org/10.1001/jamacardio.2022.2695.
[6] Blankenberg S, Seiffert M, Vonthein R, Baumgartner H, Bleiziffer S, Borger MA et al. Transcatheter or Surgical Treatment of Aortic-Valve Stenosis. N Engl J Med 2024;390(17):1572–83. https://doi.org/10.1056/NEJMoa2400685.
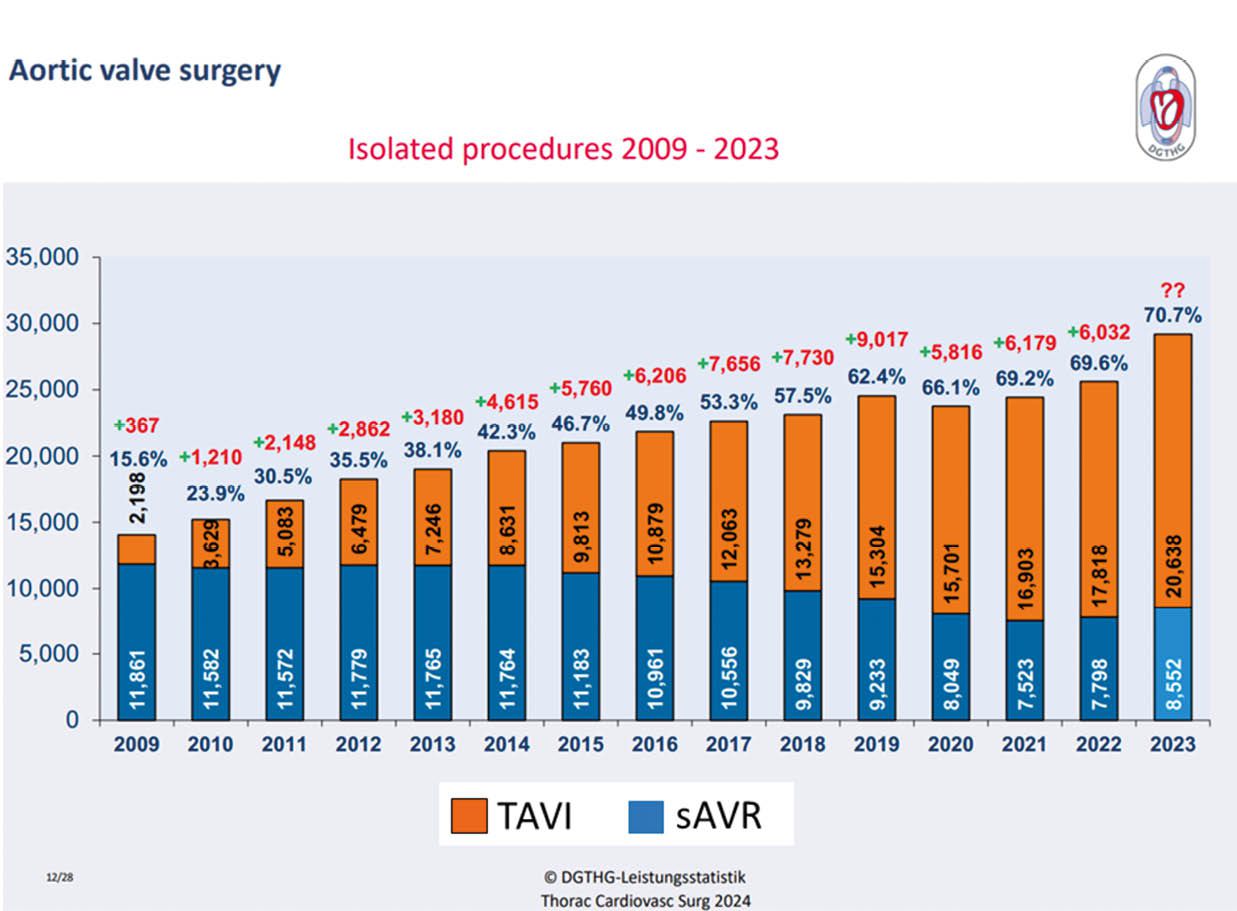
[7] Beckmann A, Meyer R, Eberhardt J, Gummert J, Falk V. German Heart Surgery Report 2023: The Annual Updated Registry of the German Society for Thoracic and Cardiovascular Surgery. Thorac Cardiovasc Surg 2024;72(5):329–45. https://doi.org/10.1055/s-0044-1787853.
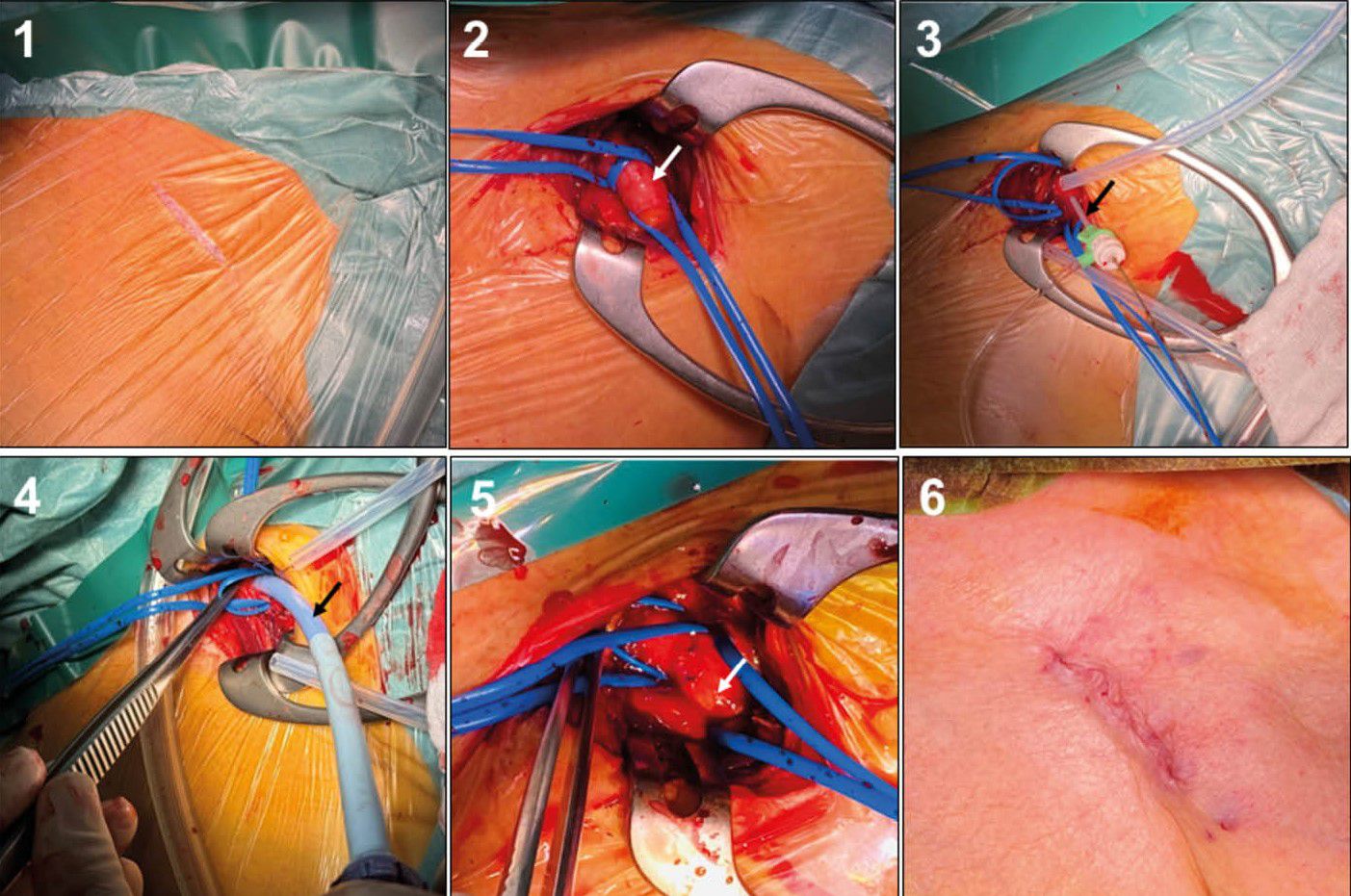
[8] Tagliari AP, Taramasso M. New Practices in Transcatheter Aortic Valve Implantation: How I Do It in 2023. J Clin Med 2023;12(4). https://doi.org/10.3390/jcm12041342.
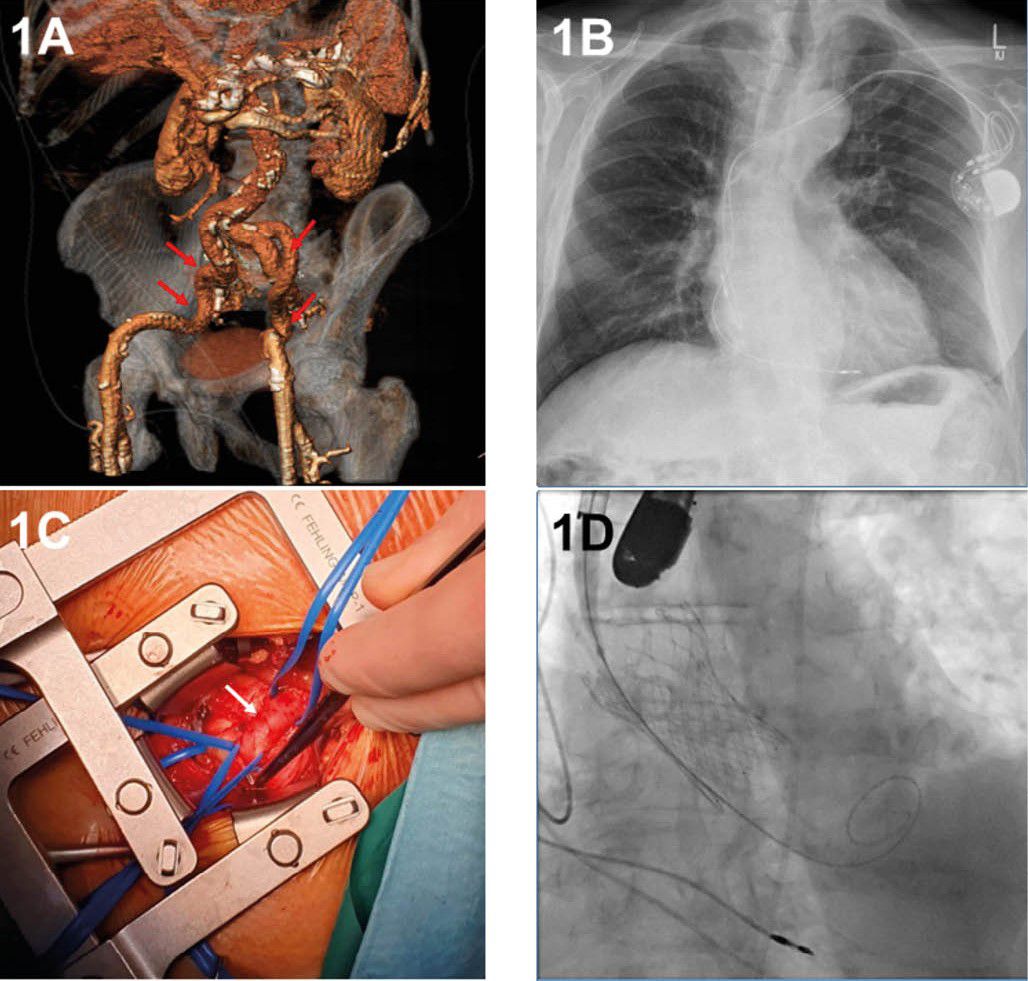
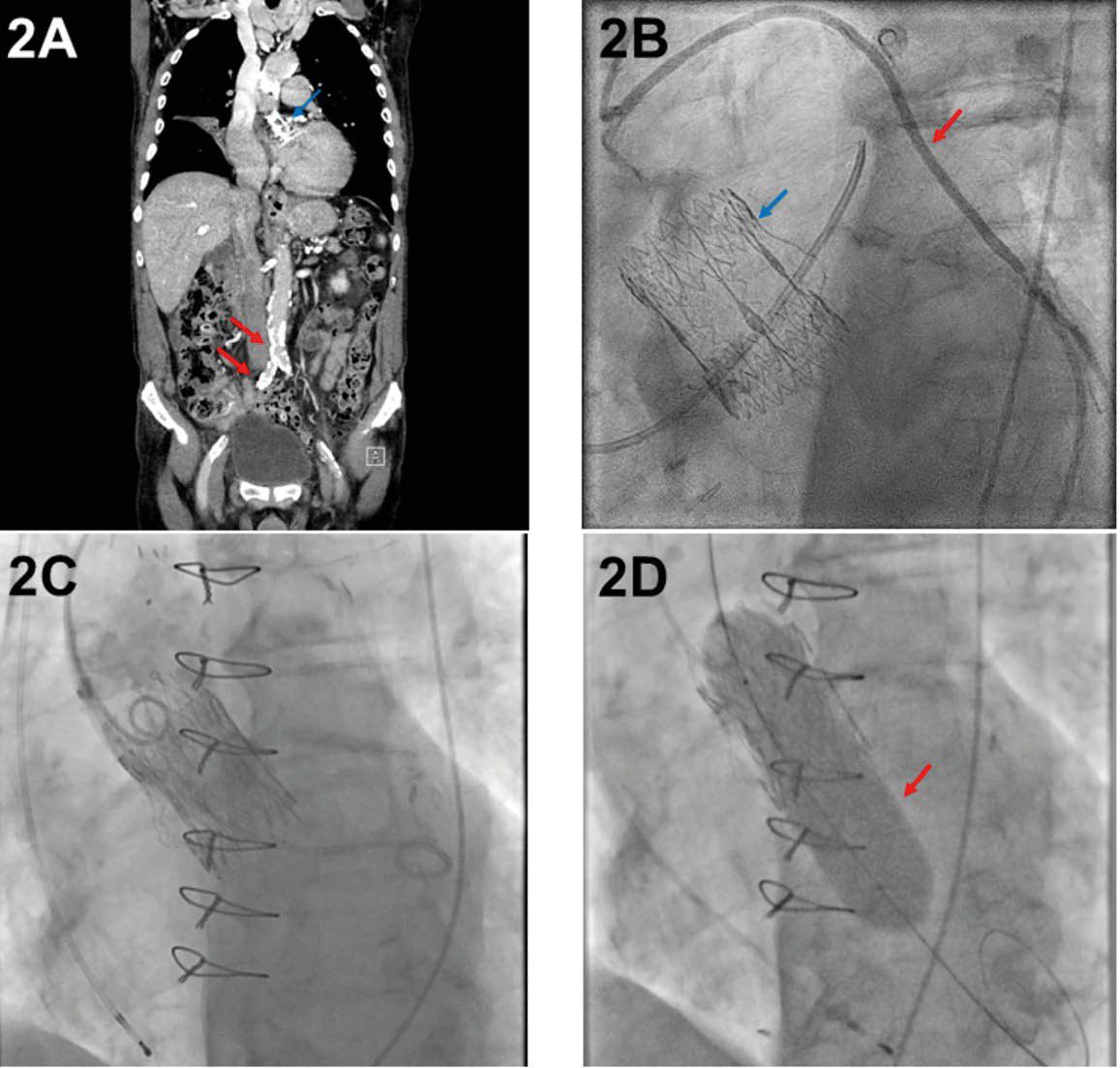
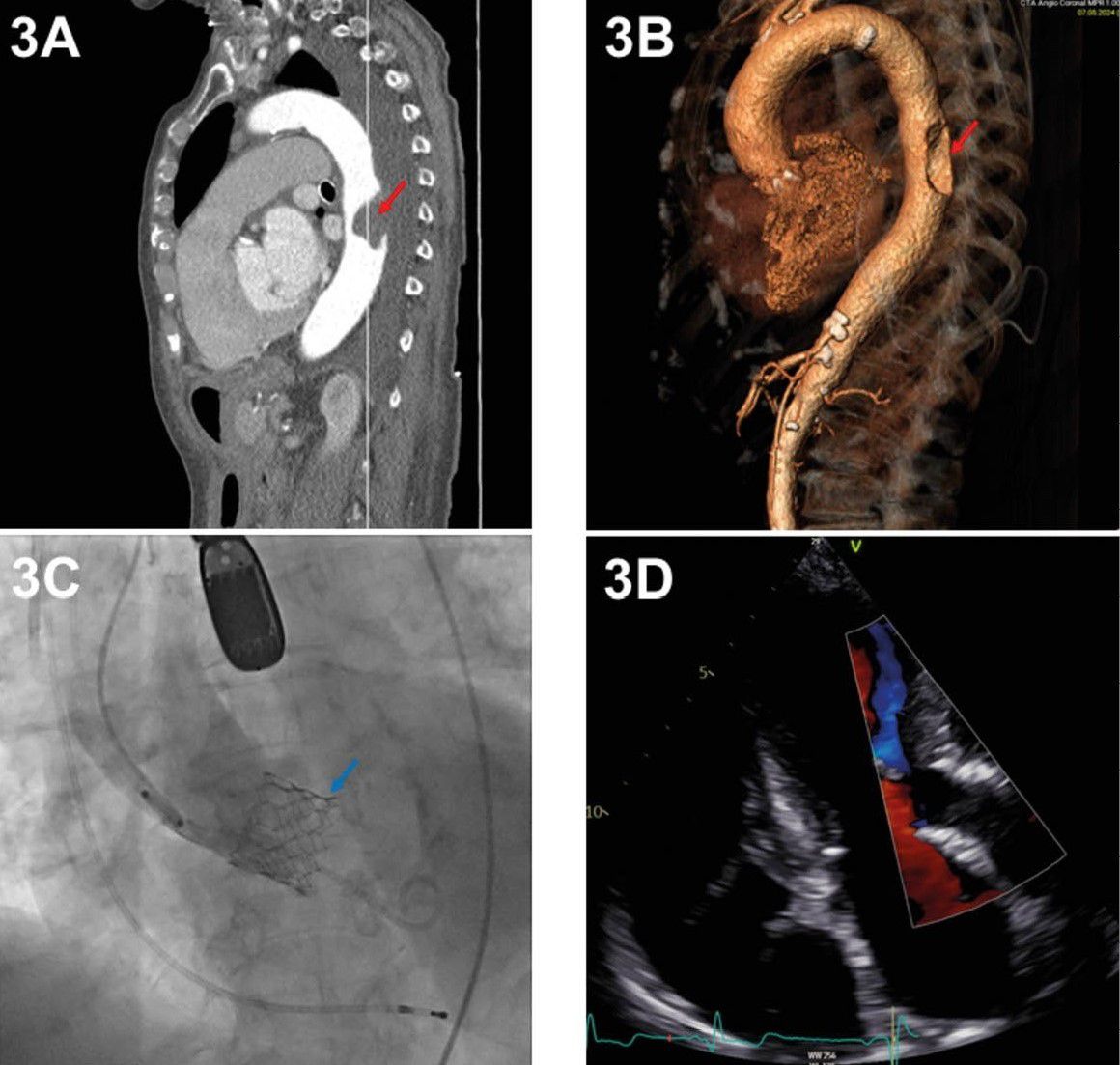
[9] Ramlawi B, Anaya-Ayala JE, Reardon MJ. Transcatheter aortic valve replacement (TAVR): access planning and strategies. Methodist Debakey Cardiovasc J 2012;8(2):22–5. https://doi.org/10.14797/mdcj-8-2-22.
[10] Barbash IM, Sharon A. In the Garden of Forking Paths: Choosing Between Alternative Access for TAVR. Cardiovasc Revasc Med 2022;40:11–2. https://doi.org/10.1016/j.carrev.2022.05.013.
[11] Abusnina W, Machanahalli Balakrishna A, Ismayl M, Latif A, Reda Mostafa M, Al-Abdouh A et al. Comparison of Transfemoral versus Transsubclavian/Transaxillary access for transcatheter aortic valve replacement: A systematic review and meta-analysis. Int J Cardiol Heart Vasc 2022;43:101156. https://doi.org/10.1016/j.ijcha.2022.101156.
[12] Palmerini T, Saia F, Kim W-K, Renker M, Iadanza A, Fineschi M et al. Vascular Access in Patients With Peripheral Arterial Disease Undergoing TAVR: The Hostile Registry. JACC Cardiovasc Interv 2023;16(4):396–411. https://doi.org/10.1016/j.jcin.2022.12.009.
[13] Beurtheret S, Karam N, Resseguier N, Houel R, Modine T, Folliguet T et al. Femoral Versus Nonfemoral Peripheral Access for Transcatheter Aortic Valve Replacement. J Am Coll Cardiol 2019;74(22):2728–39. https://doi.org/10.1016/j.jacc.2019.09.054.
[14] Herremans A, Stevesyns DT, El Jattari H, Rosseel M, Rosseel L. The Place of Transaxillary Access in Transcatheter Aortic Valve Implantation (TAVI) Compared to Alternative Routes-A Systematic Review Article. Rev Cardiovasc Med 2023;24(5):150. https://doi.org/10.31083/j.rcm2405150.
[15] Schofer N, Deuschl F, Conradi L, Lubos E, Schirmer J, Reichenspurner H et al. Preferential short cut or alternative route: the transaxillary access for transcatheter aortic valve implantation. J Thorac Dis 2015;7(9):1543–7.
[16] Sündermann SH, Dreger H, Hinkov H, Kempfert J. The 10 Commandments for Transaxillary TAVI. Innovations (Phila) 2023;18(3):212–6. https://doi.org/10.1177/15569845231177055.
[17] Fraccaro C, Napodano M, Tarantini G, Gasparetto V, Gerosa G, Bianco R et al. Expanding the eligibility for transcatheter aortic valve implantation the trans-subclavian retrograde approach using: the III generation CoreValve revalving system. JACC Cardiovasc Interv 2009;2(9):828–33. https://doi.org/10.1016/j.jcin.2009.06.016.
[18] Chung CJ, Kaneko T, Tayal R, Dahle TG, McCabe JM. Percutaneous versus surgical transaxillary access for transcatheter aortic valve replacement: a propensity-matched analysis of the US experience. EuroIntervention 2022;17(18):1514–22. https://doi.org/10.4244/EIJ-D-21-00549.
[19] Durand E, Avinée G, Gillibert A, Tron C, Bettinger N, Bouhzam N et al. Analysis of length of stay after transfemoral transcatheter aortic valve replacement: results from the FRANCE TAVI registry. Clin Res Cardiol 2021;110(1):40–9. https://doi.org/10.1007/s00392-020-01647-4.
[20] Hochholzer W, Nührenberg T, Flierl U, Olivier CB, Landmesser U, Möllmann H et al. Antithrombotische Therapie nach strukturellen kardialen Interventionen. Kardiologe 2021;15(1):57–70. https://doi.org/10.1007/s12181-020-00441-w.