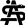Kaposi-Tumor-ähnliches Hämangioendotheliom –
fallspezifisches perioperatives Management
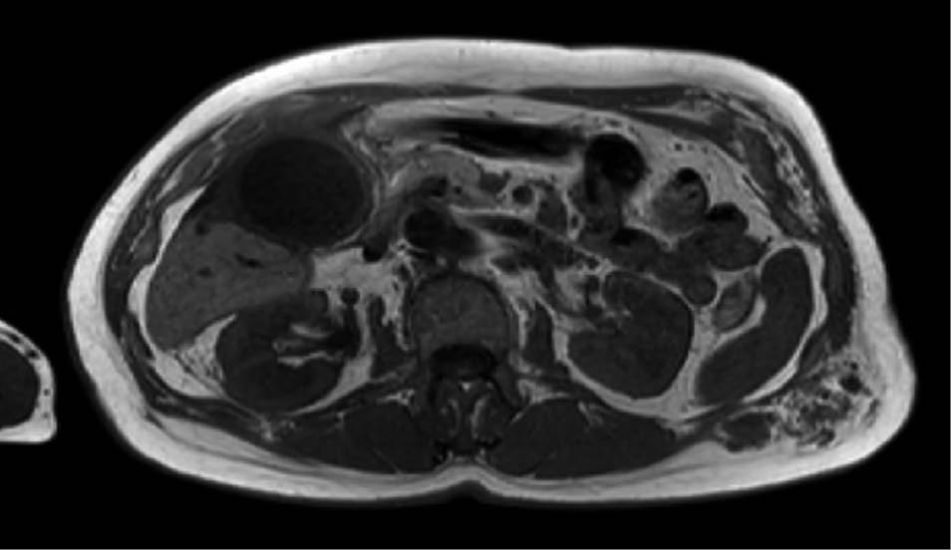
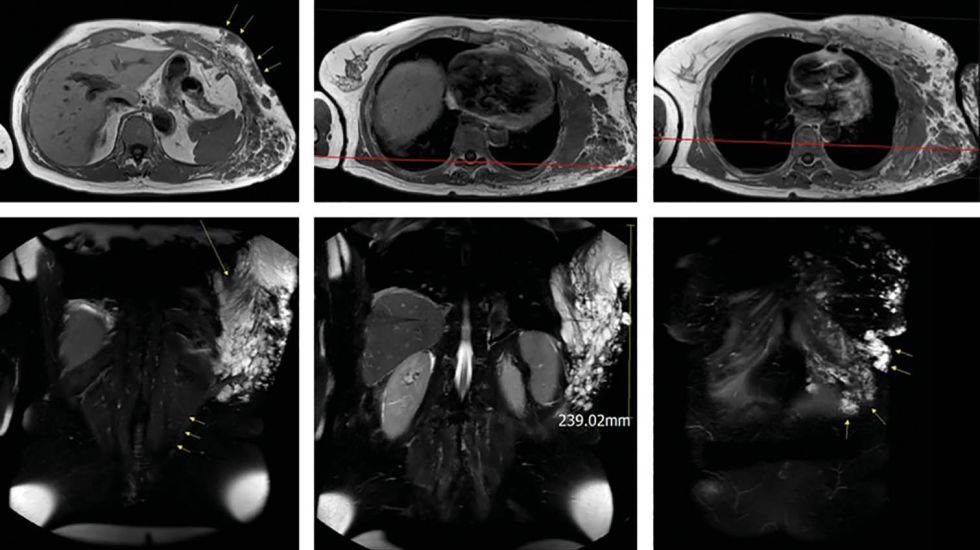
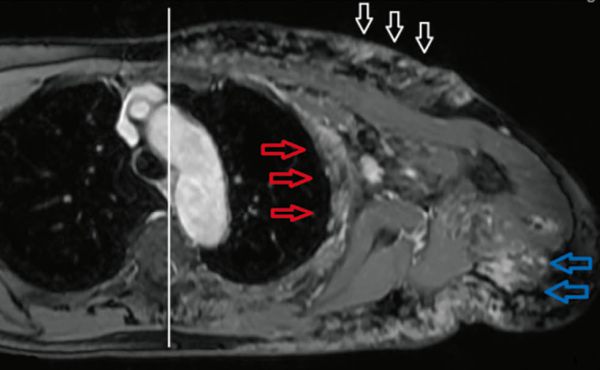
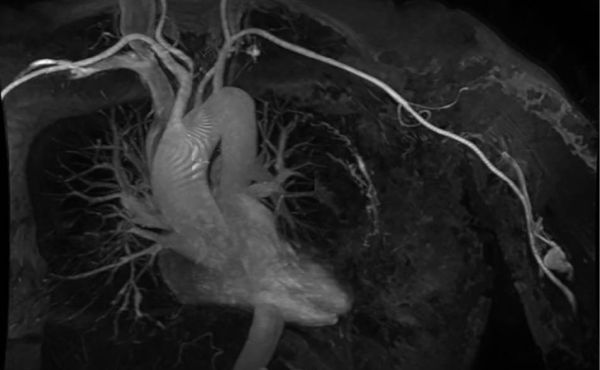
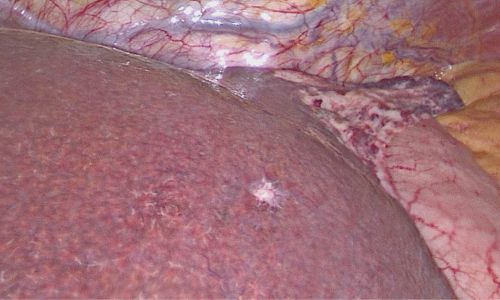
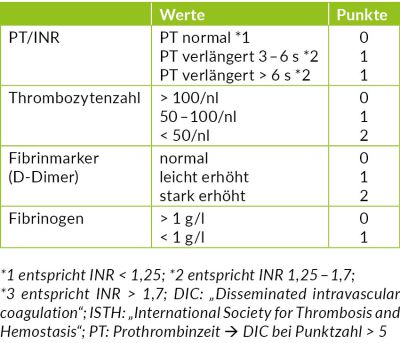
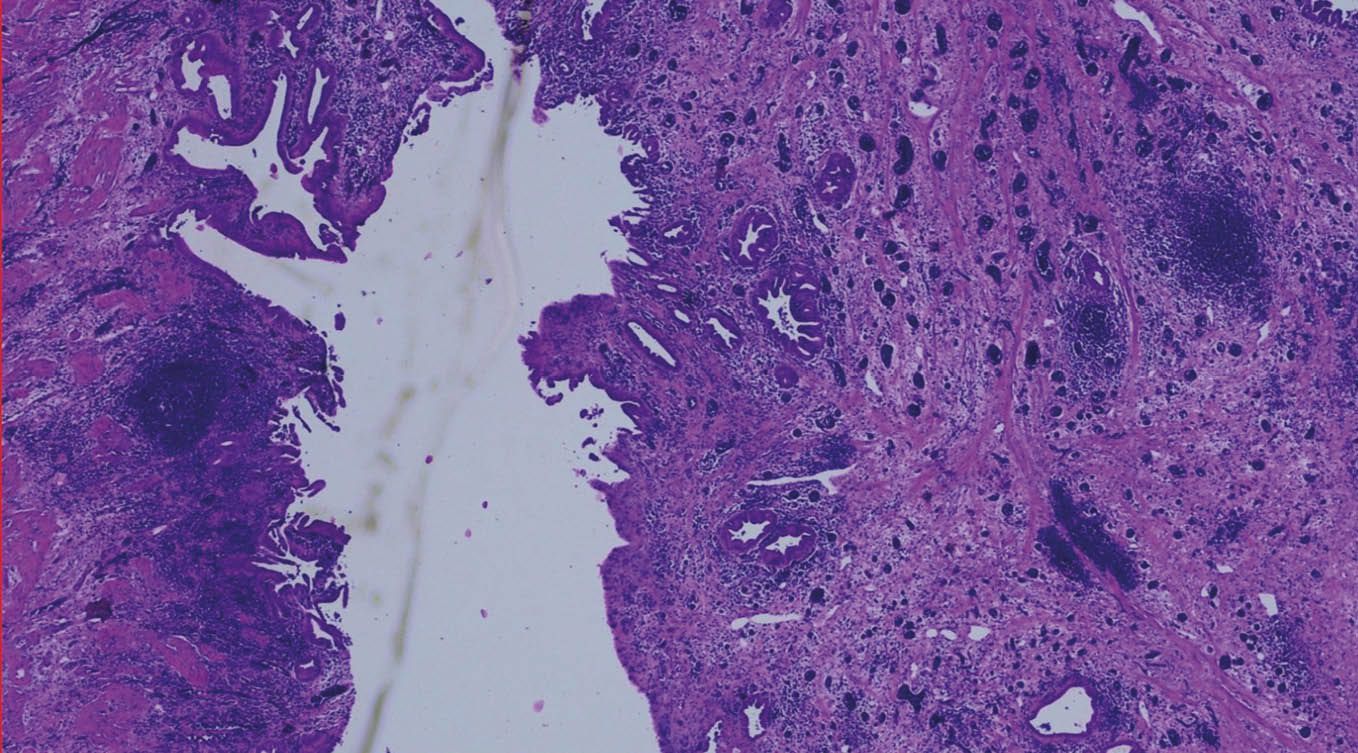
Laparoskopische Cholezystektomie für symptomatische Cholezystolithiasis (CCL) bei „Kasabach-Merritt-Syndrom“ (KMS)
Laparoskopische Cholezystektomie für symptomatische Cholezystolithiasis (CCL) bei „Kasabach-Merritt-Syndrom“ (KMS)

Foto: Adobe Stock | #399729635
S. Arndt1, C. Wex2, I. Häusler-Pliske2, D. Jechorek3, H. Krause4, Z. Halloul1, F. Meyer2
Sekundäreinreichung nach Erstveröffentlichung im Open Access Modus unter der Creative Commons Lizenz BY 4.0 beim „de-Gruyter-Verlag“
1 Arbeitsbereich Gefäßchirurgie; Klinik für Allgemein-, Viszeral-, Gefäß- und Transplantationschirurgie
2 Klinik für Allgemein-, Viszeral-, Gefäß- und Transplantationschirurgie
3 Institut für Pathologie
4 Abteilung Kinderchirurgie, Kindertraumatologie und Kinderurologie; Klinik für Allgemein-, Viszeral-, Gefäß- und Transplantationschirurgie Universitätsklinikum Magdeburg Ä. ö. R.
S. Arndt1, C. Wex2, I. Häusler-Pliske2, D. Jechorek3, H. Krause4, Z. Halloul1, F. Meyer2
Sekundäreinreichung nach Erstveröffentlichung im Open Access Modus unter der Creative Commons Lizenz BY 4.0 beim „de-Gruyter-Verlag“
1 Arbeitsbereich Gefäßchirurgie; Klinik für Allgemein-, Viszeral-, Gefäß- und Transplantationschirurgie
2 Klinik für Allgemein-, Viszeral-, Gefäß- und Transplantationschirurgie
3 Institut für Pathologie
4 Abteilung Kinderchirurgie, Kindertraumatologie und Kinderurologie; Klinik für Allgemein-, Viszeral-, Gefäß- und Transplantationschirurgie Universitätsklinikum Magdeburg Ä. ö. R.

Dr. med. Stephan Arndt (Foto: privat)