Dabei handelt es sich in der Regel um Dauertherapien, die mit einem erhöhten Risiko für infektiöse Komplikationen einhergehen bzw. bei Steroiden ein breites Spektrum an Nebenwirkungen (z. B. Osteoporose oder Hyperglykämie) aufweisen.
Etwa 10 – 15 % der Patientinnen und Patienten sprechen auf diese Standardtherapie nicht an. Eine solche Patientin wurde von Prof. Haghikia und seinem Team an der Universitätsmedizin Magdeburg betreut.
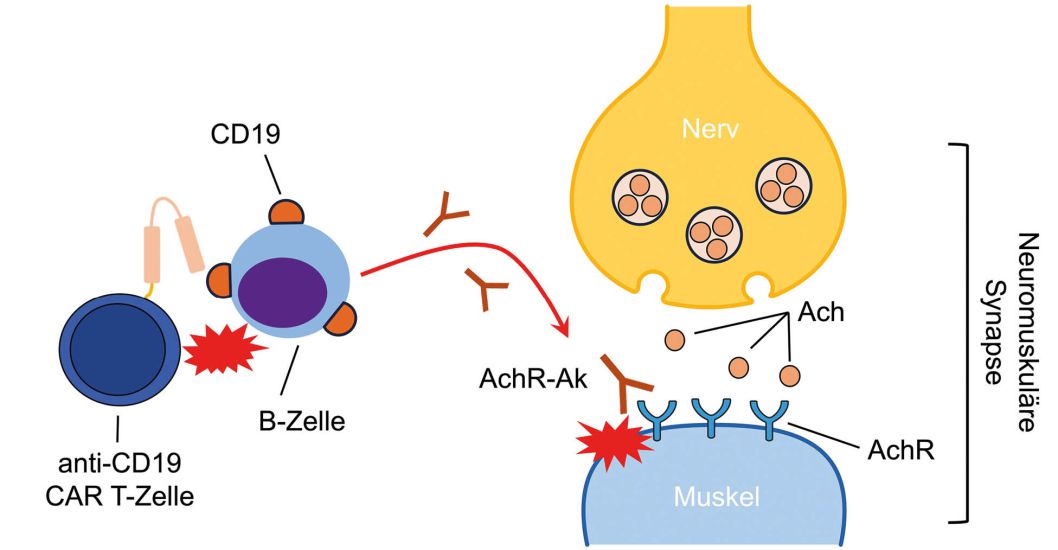
Bei ihr wurde vor mehr als 10 Jahren eine MG diagnostiziert, und es konnten die typischen Autoantikörper gegen AchR nachgewiesen werden. Sie war bereits mehrfach vorbehandelt worden (u. a. mit Steroiden, Azathioprin, Rituximab, MMF und Thymektomie), musste jedoch in den letzten 2 Jahren mehrfach intensivmedizinisch behandelt werden. Auch ihre Lebensqualität war stark eingeschränkt. In Magdeburg gelang es zwar, die Krankheitsdynamik durch den „beyond-state-of-the-art“-Einsatz des Proteasom-Inhibitors Bortezomib zu stabilisieren, jedoch war zuletzt eine zunehmende Krankheitsaktivität zu beobachten.
In dieser Situation entschlossen sich Prof. Haghikia und Prof. Mougiakakos, jetzt in Magdeburg, zu einem weltweit ersten individuellen Heilversuch mit anti-CD19 CAR T-Zellen.
Unterstützt wurden sie dabei von einer kooperierenden US-Firma namens Kyverna Therapeutics. Der deutschstämmige Geschäftsführer Peter Maag wollte der Patientin helfen und stellte seine Produktionskapazitäten zur Verfügung.
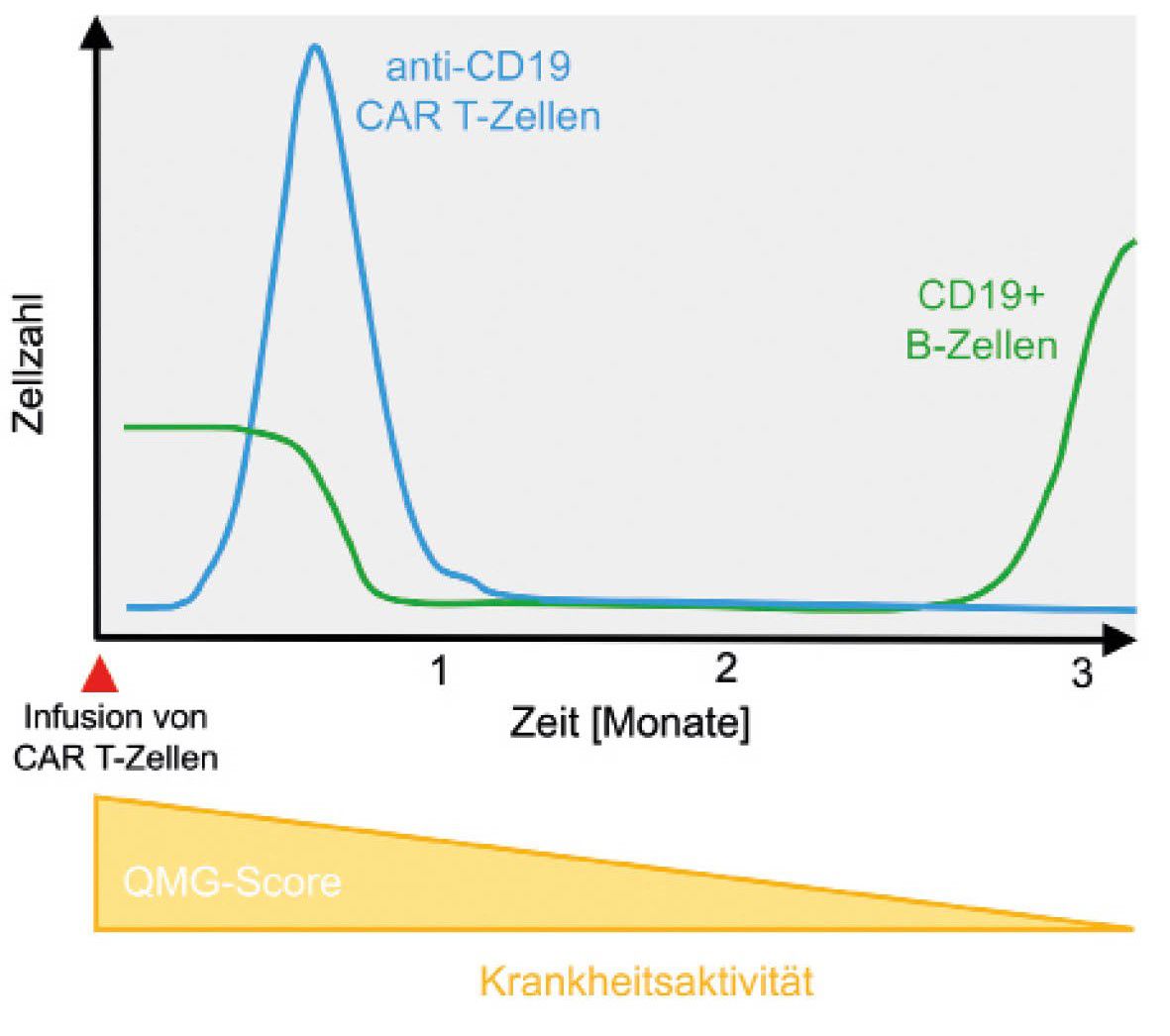
So konnte die Patientin vor 10 Monaten erfolgreich behandelt werden. Sie vertrug die Infusion mit den CAR T-Zellen sehr gut und erste sichtbare Erfolge stellten sich relativ schnell ein. Während des stationären Aufenthaltes war die Patientin auf einen Rollator als Gehhilfe angewiesen und bereits 10 Tage nach der Infusion der Anti-CD19 CAR T-Zellen konnte sie wieder frei laufen. Die Kraft kehrte zurück, die Müdigkeit verschwand und die Patientin war nahezu beschwerdefrei. Nach etwa vier Monaten kehrten auch die B-Zellen zurück, aber nicht die Krankheit. So lag der international gebräuchliche Quantitative Myasthenia gravis (QMG) Test, der u. a. die Beurteilung von Muskelkraft (inkl. Schlucken und Sprechen) und Vitalkapazität beinhaltet, zum Zeitpunkt der Zellinfusion bei 15 Punkten (Punktewerte 0 – 39) und ist jetzt bei 2. Eine Substitution von Immunglobulinen war nie nötig. Jetzt hoffen die Professoren Haghikia und Mougiakakos gemeinsam mit der Patientin, dass die Wirkung der CAR T-Zellen lange anhält, möglichst für immer.