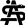Ein weiterer kritischer Faktor, der einer operativen Entfernung von KRLM entgegenstehen kann, ist die Limitation hinsichtlich der funktionellen Resektabilität. Durch vorgeschädigtes Leberparenchym, verursacht durch Krankheiten, Lebensgewohnheiten oder Chemotherapien, kann die Möglichkeit einer Metastasenresektion eingeschränkt sein. Postoperativ muss für den Patienten hinreichend Lebergewebe mit ausreichender Funktion vorhanden sein. Bei einem gesunden Leberparenchym sollten dabei 25 % Restleber ausreichend sein [10]. Es ist aber nicht ausreichend, das künftige Restvolumen der Leber lediglich mit radiologischen Methoden zu bestimmen, sondern es müssen auch funktionelle Parameter miteinbezogen werden, da das Volumen der Leber nicht in jedem Fall mit der entsprechenden Funktion korreliert [11]. Spezifische Leberfunktionstests, welche Aufschluss über die hepatozelluläre Funktion geben, können hier hilfreich sein. Eine Möglichkeit bietet dazu der LiMAx-Test, mit dessen Hilfe in Kombination mit radiologischer Volumetrie die zukünftige Funktion der Restleber eingeschätzt werden kann [12]. Dabei wird beim LiMAx-Test die Leberfunktion durch eine Verstoffwechselung von 13C-Methacetin durch das leberspezifische Cytochrom-P450-1A2 System ermittelt. Dieses Vorgehen reduziert das Risiko eines postoperativen Leberversagens und erhöht damit die Patientensicherheit bei ausgedehnten Leberresektionen.
Induktion der Leberhypertrophie bei kritischem Leberrestgewebe
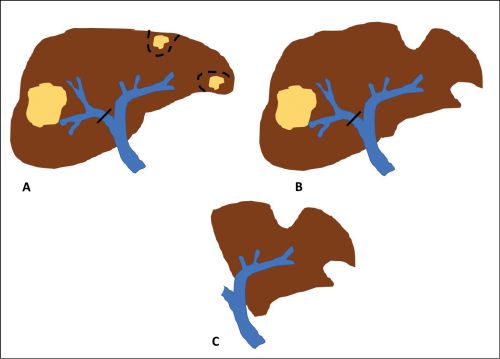
Bei kritischem Leberrestvolumen kann durch vorbereitende Maßnahmen eine Hypertrophie der zu erwartenden Restleber vor einer geplanten größeren Leberresektion induziert werden. Dies kann durch interventionelle Methoden wie einer portalvenösen Embolisierung (PVE) oder durch chirurgische Maßnahmen wie dem „In-situ-splitting“ (IsSL) der Leber erfolgen.
Bei der PVE wird nach radiologisch kontrollierter perkutaner Punktion der Pfortader die den Tumor tragende Seite verschlossen. Zu beachten gilt es, dass bei geplanten rechts erweiterten Resektionen, wo nur die linkslateralen Lebersegmente (II, III) erhalten werden sollen, auch die Segment-IV-Äste, die meist aus der linken Pfortader entspringen, embolisiert werden müssen, um den gewünschten Effekt zu erzielen. In 85 % der so vorbehandelten Patienten ist eine Leberresektion nach 3 – 4 Wochen möglich [13, 14]. Bei unzureichender Hypertrophie kann zusätzlich die Lebervene der zu resezierenden Seite interventionell verschlossen werden, was eine zusätzliche Hypertrophie induzieren kann [15].
Beim IsSL der Leber wird intraoperativ der Pfordaderast der zu resezierenden Leberseite ligiert und das Leberparenchym in der geplanten Resektionsebene gespalten. Hierdurch sollen intrahepatische Shunts durchtrennt und damit die Leberhypertrophie beschleunigt werden. Dadurch kann bei ca. 80 % der Fälle innerhalb 7 – 14 Tagen eine Volumenzunahme der Restleber erreicht werden [16]. Die gefürchtete hohe Morbidität von etwa 40 % und Mortalität von ca. 15 % dieser Technik kann durch eine gezielte und differenzierte Patientenauswahl um etwa zwei Drittel reduziert werden [17]. Ein Vorteil der IsSL ist, dass im Rahmen des Eingriffs evtl. kleinere KRLM an der zu erhaltenden Leberseite entfernt werden können. Dadurch können auch bilateral metastasierte Situationen angegangen werden. Wichtig ist dabei immer eine differenzierte und umsichtige Auswahl der angewandten chirurgische Resektionstechnik.
Chirurgische Techniken der Leberresektion
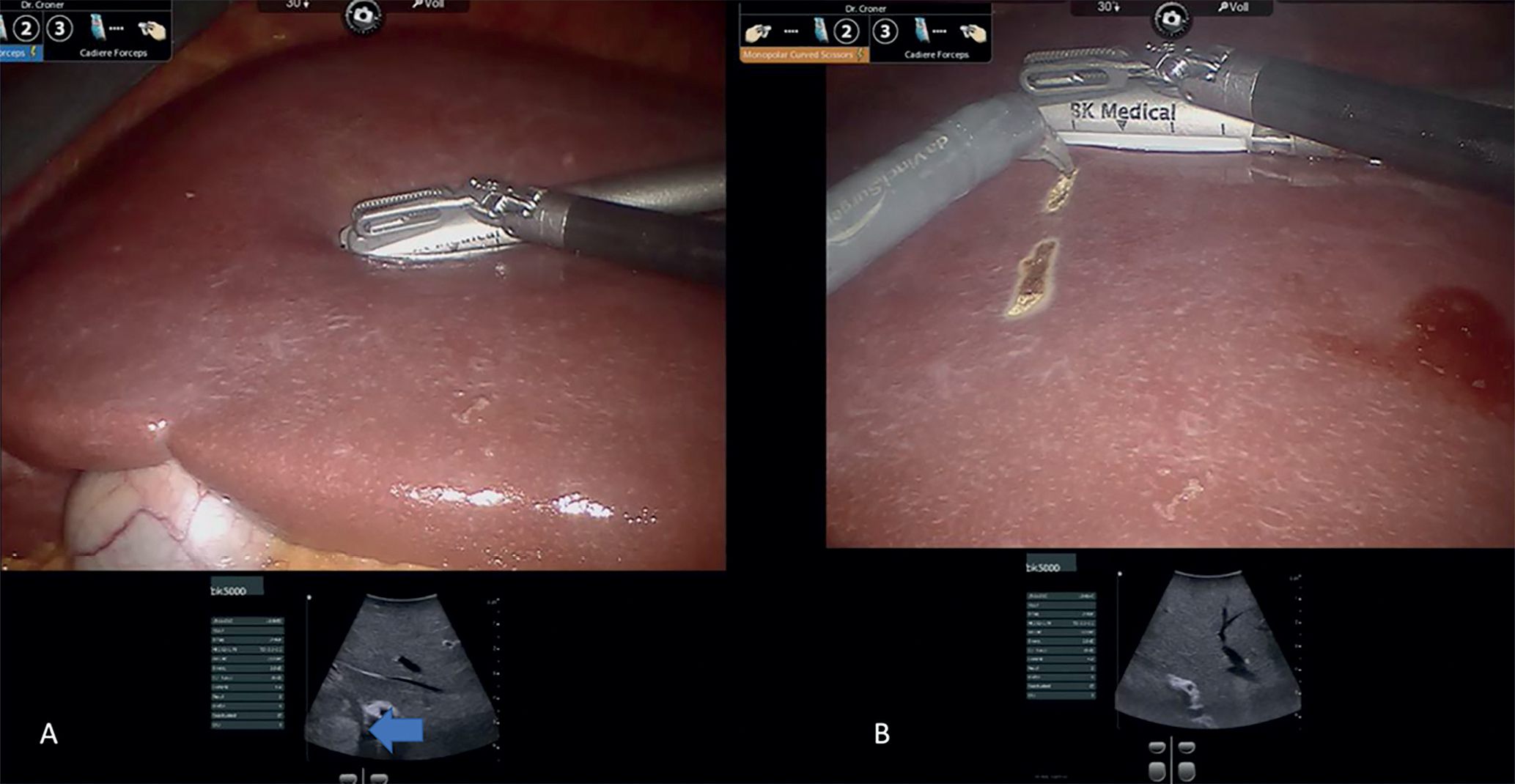
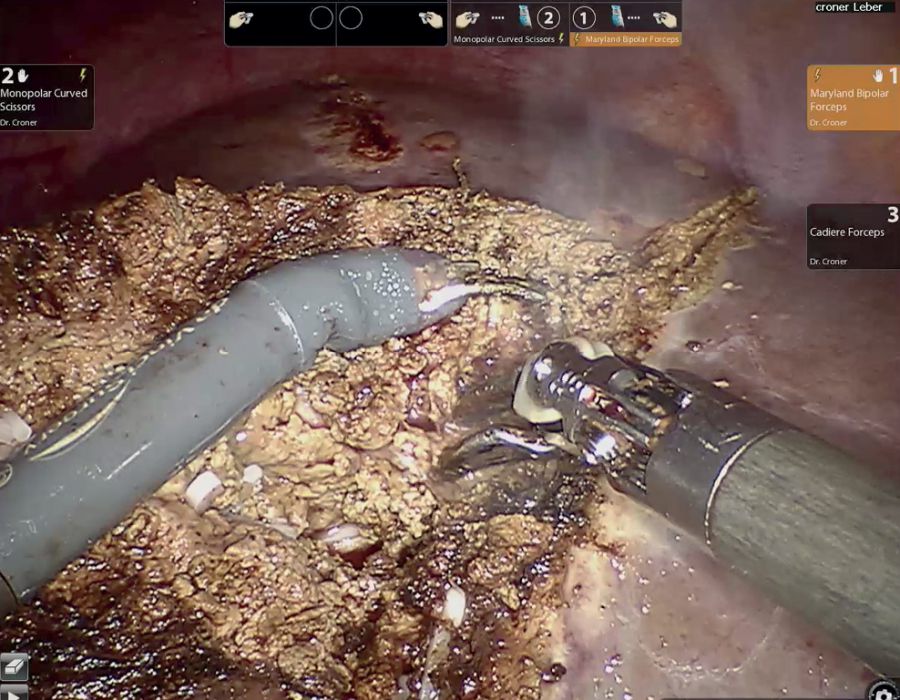
Das Ziel der Resektion von KRLM ist eine komplette Entfernung der Metastasen mit ausreichendem Sicherheitsabstand, aber möglichst Parenchym-sparend. Es soll immer möglichst viel gesundes Leberrestgewebe erhalten werden. Hierfür ist die Lage der Metastase in der Leber, deren Größe und die Anzahl der KRLM entscheidend. Die Leber ist ein sehr gut durchblutetes Organ. Etwa 1,5 l unseres Blutvolumens fließen pro Minute durch das Lebergewebe. Der intraoperative Blutverlust und die Transfusionsrate wurden als unabhängiger Prognosefaktor bei der chirurgischen Therapie von KRLM identifiziert [18]. Beide Faktoren sind durch den Operateur beeinflussbar. Eine Kontrolle der extrahepatischen Blutgefäße, d. h. des Lebereinstroms und -ausstroms vor der Parenchymdissektion hilft, Blutungskomplikationen vorzubeugen. Für die blutungsarme Dissektion des Leberparenchyms stehen Ultraschallaspiratoren (CUSA®) oder Wasserstrahldissektoren zur Verfügung. Mit deren Hilfe können das Leberparenchym durchtrennt und dabei intrahepatische Blutgefäße und Gallengänge selektiv dargestellt und versorgt werden. Dies trägt maßgeblich zur Reduktion des intraoperativen Blutverlustes bei und ermöglicht ein sehr präzises Arbeiten. Die perioperative Morbidität bei der chirurgischen Therapie von KRLM wird in der Literatur für kleinere Komplikationen (Clavien-Dindo ≤ Grad 2) mit 30 % und für größere Komplikationen (Clavien-Dindo ≥ Grad 3a) mit 16 % beziffert [19]. Die Mortalität beträgt nach deutschlandweiten Erhebungen 5,5 % [20]. Niederländische Erhebungen an einer Kohorte von 4.639 Patienten haben gezeigt, dass bei einer starken Zentralisierung und Standardisierung der operativen Prozeduren die perioperative Morbidität für größere Komplikationen auf 6,2 % und die Mortalität auf 1,4 % reduziert werden kann [21].
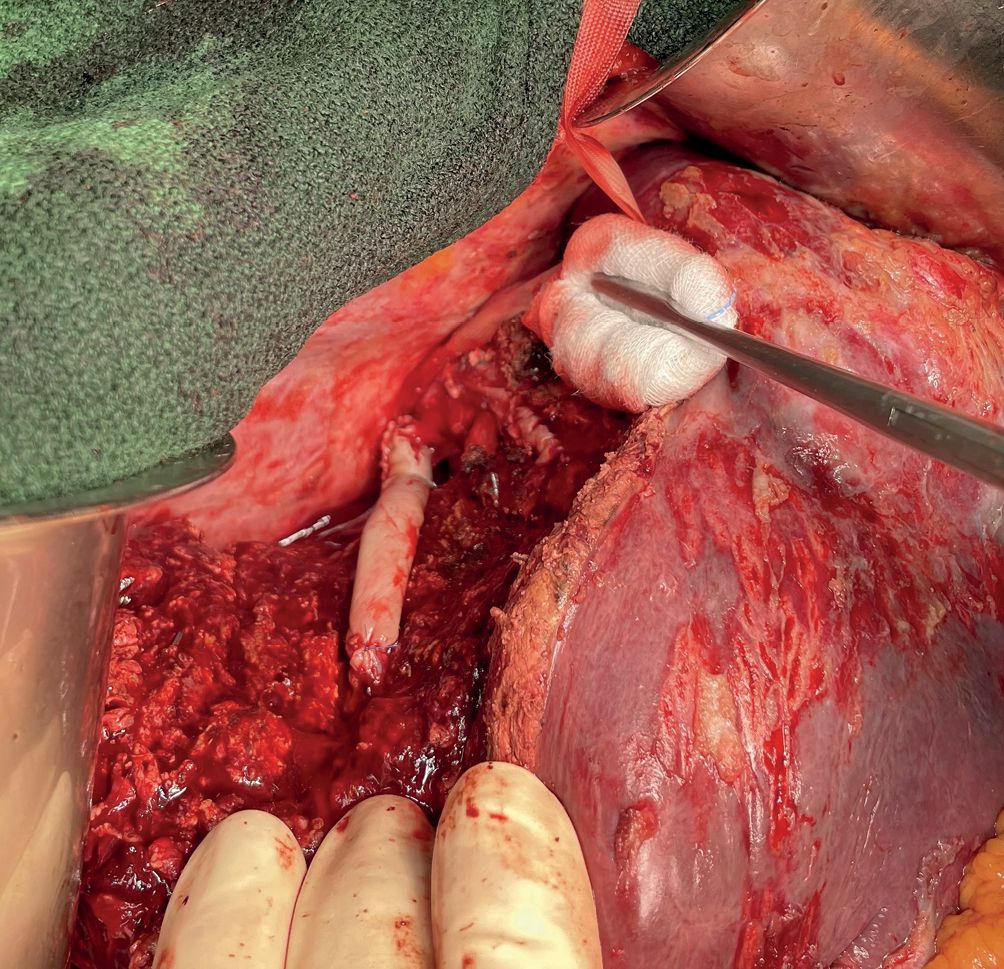
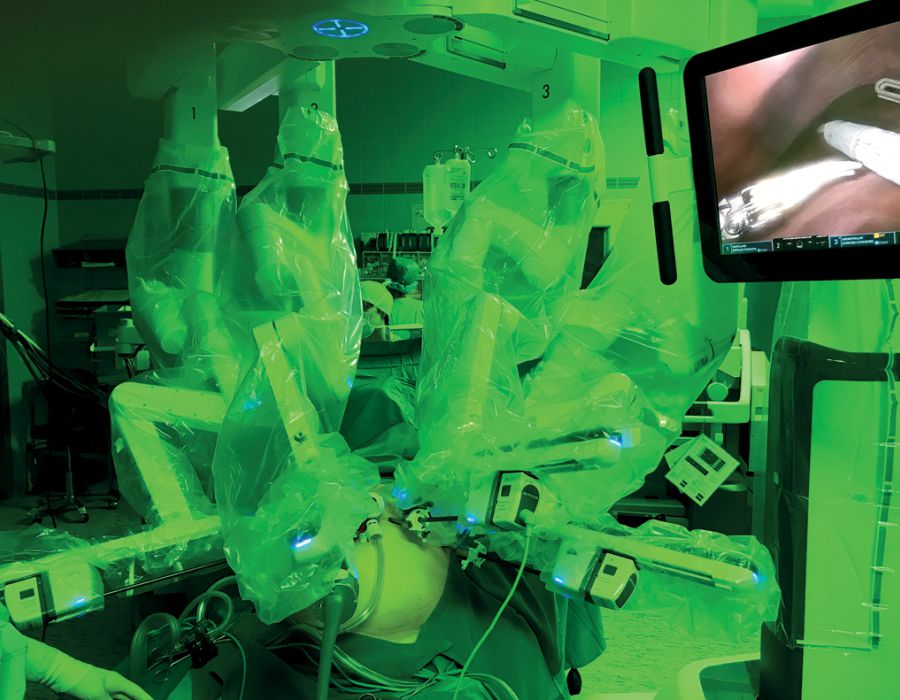
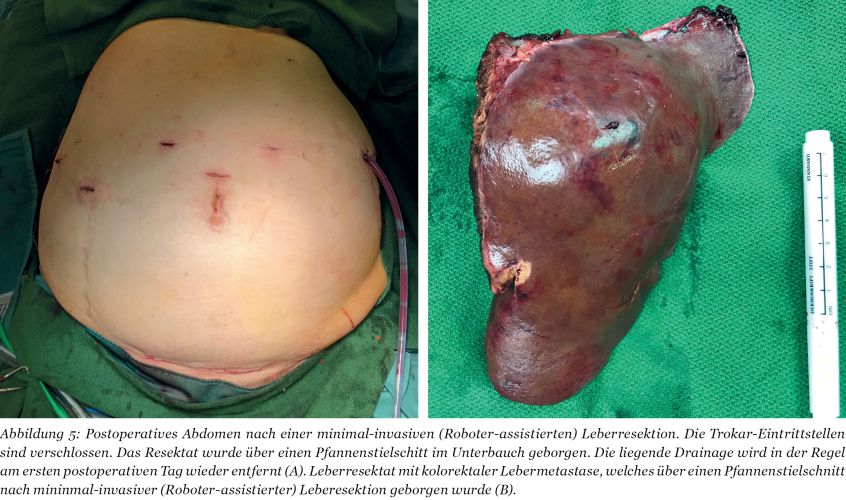
Durch den Einsatz minimal-invasiver Techniken konnte in einer norwegischen, prospektiven Studie (OSLO-COMET) die perioperative Morbidität von 31 % in der offenen Chi-rurgie auf 19 % in der laparoskopischen Gruppe reduziert werden. Auch der Krankenhausaufenthalt hat sich dadurch signifikant verkürzt [22]. Dies als auch ein geringerer Blutverlust mit weniger Bluttransfusionen bei minimal-invasiven vs. offenen Operationen wurden durch andere Studien bestätigt. Dabei ist die onkologische Qualität und das Langzeitüberleben der Patienten bei der Anwendung minimal-invasiver Operationen gleichwertig wie bei offenen Eingriffen [23-26]. Die Anwendung sogenannter Operationsroboter ist ein noch junges Verfahren bei der chirurgischen Therapie von KRLM. Auch diese Technik bietet für den Patienten alle Vorteile der minimal-invasiven Chirurgie mit gleichwertigem onkologischem Outcome verglichen mit den offenen Operationen. Die Technik gilt als sicher und ermöglicht durch technische Innovationen Limitationen der konventionellen laparoskopischen Chirugie zu überwinden [27-30].