Die CAR-T-Zell-Therapie ist eine innovative und vielversprechende Immuntherapie, die auf gentechnisch veränderten T-Zellen mit synthetischen, chimären Antigenrezeptoren („CAR“s) basiert.
Durch die Zulassung neuer Produkte konnte sie an der Universitätsmedizin Halle in den letzten Jahren zunehmend in die klinische Routine der Versorgung von Patienten mit B-Zell-Lymphomen und Multiplem Myelom integriert werden.

Dr. Judith Schaffrath
Die CAR-T-Zell-Therapie stellt eine neue Möglichkeit zur Behandlung maligner Erkrankungen dar. Diese spezifische Zelltherapie nutzt gentechnisch veränderte autologe T-Zellen zur gezielten Zerstörung von Tumorzellen.
Normalerweise präsentieren Zellen im menschlichen Körper Antigene auf ihrer Zelloberfläche gebunden an Moleküle der Human Leukocyte Antigens (HLA). Ein T-Lymphozyt mit passendem T-Zellrezeptor erkennt ein solches HLA-gebundenes Antigen und wird hierdurch aktiviert. Für diese Aktivierung sind aber zwingend kostimulatorische Signale notwendig, die z. B. durch auf T-Zellen exprimiertes CD28 vermittelt werden. Aktivierte T-Zellen sind dann in der Lage, die Antigen exprimierenden Zellen zu lysieren. Tumorzellen regulieren die Erkennung durch das Immunsystem herunter, z. B. indem sie die Expression kostimulatorischer Moleküle oder von HLA verringern und so der Erkennung durch die T-Zellen entkommen.
Um dem entgegenzuwirken, werden bei der CAR-T-Zell-Therapie den Patienten autologe T-Zellen entnommen und genetisch modifiziert, sodass sie einen Chimären Antigenrezeptor (CAR) auf ihrer Oberfläche exprimieren. Der CAR besteht aus einer extrazellulären antigenbindenden und einer intrazellulären stimulatorischen Domäne (z. B. CD28) sowie einer oder mehrerer intrazellulärer kostimulatorischer Domänen. Dadurch werden die Antigenbindung und die Zellaktivierung „kurzgeschlossen“. Es reicht dann die einfache, HLA-unabhängige Erkennung des speziellen Antigens aus, um diese CAR-T-Zellen zu aktivieren, eine spezifische Immunantwort auszulösen und die Tumorzelle abzutöten (Kochenderfer et al. 2015).
Der prinzipielle Ablauf ist in Abbildung 1 dargestellt. Bei Patienten mit gestellter Indikation zur CAR-T-Zell-Therapie werden ohne Vorbehandlung in einer Apherese – diese kann ambulant erfolgen – Leukozyten des peripheren Blutes gewonnen. Diese Zellen werden direkt an den Hersteller versandt. Bei den herstellenden Firmen erfolgt dann die genetische Modifikation der T-Lymphozyten mit dem CAR-Konstrukt, gegebenenfalls die Expansion der Zellen unter Reinraumbedingungen und die Qualitätstestung des Produktes. Fällt diese positiv aus, kann das Produkt auf Anforderung des Zentrums an dieses geliefert werden.
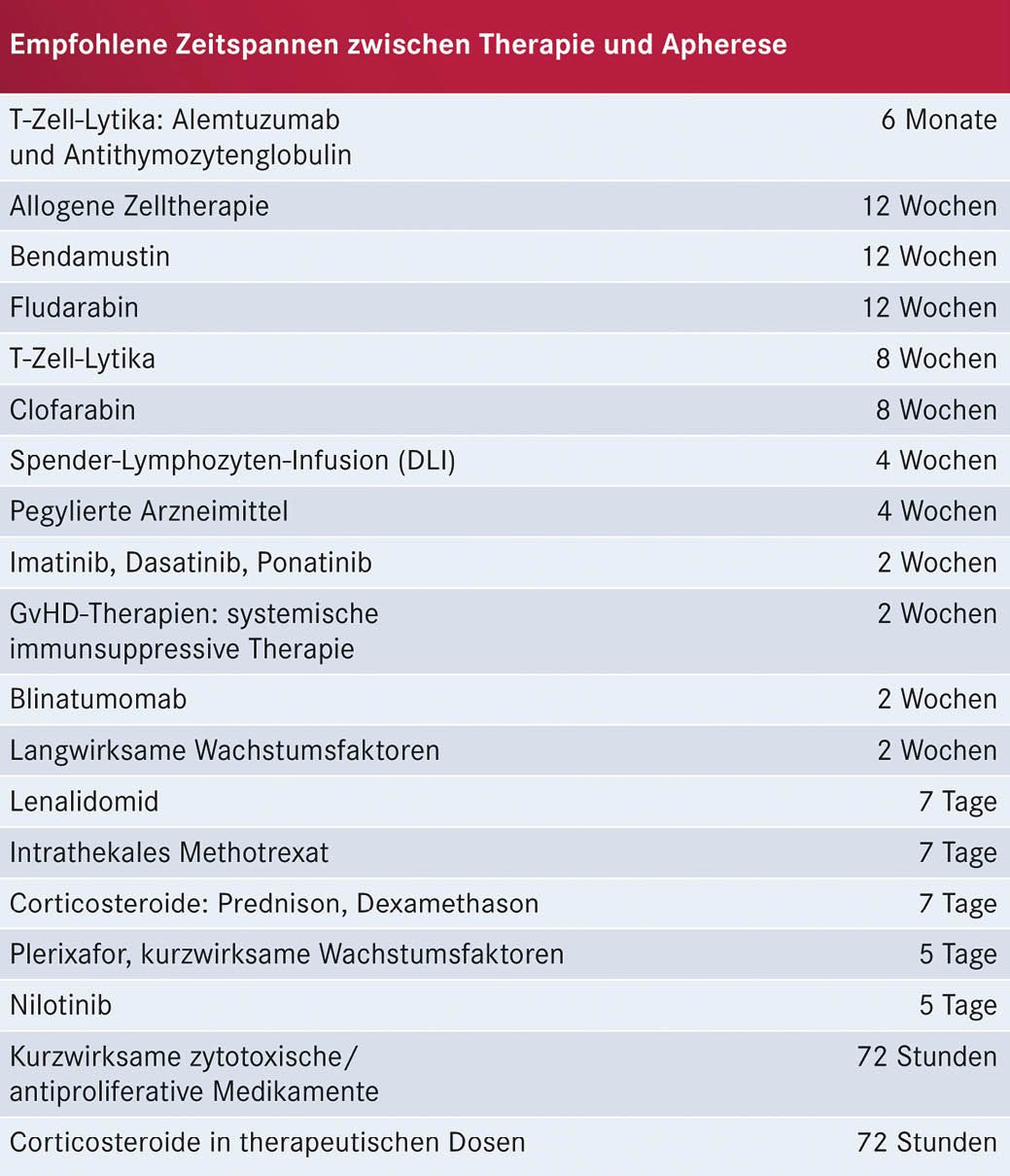
Entscheidend bei diesem Schritt ist die Gewinnung einer ausreichenden Menge von vitalen T-Lymphozyten. Dies kann z. B. durch eine vorangegangene Behandlung mit bestimmten Substanzen (siehe Tabelle 1, S. 16) beeinträchtigt werden (Korell et al. 2020). Ausgehend von den aktuellen und absehbaren Indikationsstellungen für CAR-T-Zellen ergibt sich damit der Bedarf für eine frühzeitige Absprache mit dem CAR-T-Zell-Therapiezentrum um Verzögerungen zu vermeiden.
Parallel zur Herstellung erfolgt die Vorbereitung der Patienten. Angesichts des Nebenwirkungspotenzials zählen hierzu Voruntersuchung und gegebenenfalls Behandlungen zur Sicherstellung einer Freiheit von Infektionen und ausreichender kardiopulmonaler Funktion. Entscheidend ist jedoch vor allem die Behandlung der Grunderkrankung. Je nach Remissionsstatus erfolgt lediglich eine Beobachtung oder aber eine überbrückende Therapie, um eine möglichst gute Remission zu erhalten.
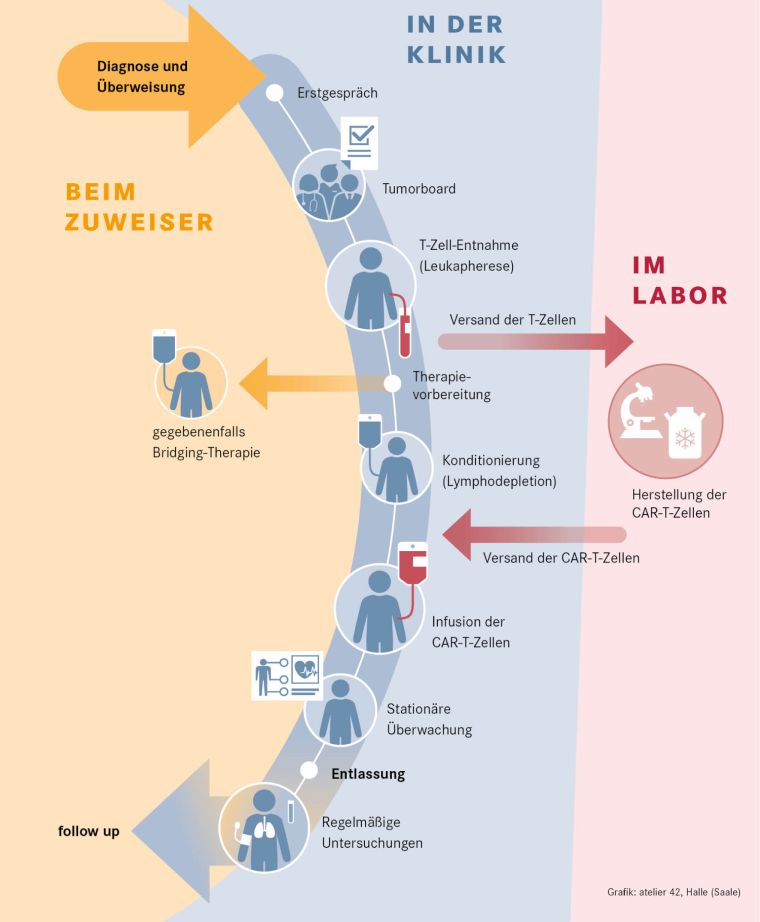
Abbildung 1: Prinzipieller Ablauf der CAR-T-Zell Herstellung und Behandlung
Die Effektivität der CAR-T-Zell-Therapie ist umso höher, je geringer die Erkrankungslast bei Gabe des Produktes ist (Dean at al. 2020; Vercellino et al. 2020). Auch aus diesem Grund ist eine frühzeitige und enge Kommunikation zwischen behandelnden Hämatologen und CAR-T-Zell-Therapiezentrum sinnvoll.
Vor Gabe der CAR-T-Zellen erfolgt eine lymphodepletierende Chemotherapie zumeist mit Cyclophosphamid und Fludarabin über fünf Tage. Die eigentliche Gabe der Zellen erfolgt unter stationären Bedingungen, da ab Gabe gravierende Komplikationen auftreten können. Zu diesen zählen vor allem ein Zytokin-Release-Syndrom (CRS) und das sogenannte Immuneffektorzell-assoziierte Neurotoxizitätssyndrom (ICANS). Beide erfordern eine spezifische Diagnostik mit mehrmaligem Monitoring pro Tag und gegebenenfalls eine unverzügliche Therapie unter Einsatz des Interleukin-6-Rezeptor-Antagonisten Tocilizumab und gegebenenfalls Notwendigkeit der intensivmedizinischen Betreuung (Yacoub-Agha et al. 2020). Beide Komplikationen treten vor allem bis Tag zehn nach Gabe der Zellen auf, die neurologischen Nebenwirkungen können jedoch auch noch mehrere Wochen nach CAR-T-Gabe einsetzen.
Zusätzlich zu diesen akuten Toxizitäten kommt es bei Patienten nach CAR-T-Zell-Therapie teilweise zu langfristigen Zytopenien mit einem typischen biphasischen Verlauf, die unter dem Begriff „Immuneffektorzell-assoziierte Hämatotoxizität“ (ICAHT) zusammengefasst werden. In Kombination mit Hypogammaglobulinämie und B-Zell-Aplasie führen sowohl gegen CD19 als auch gegen BCMA ausgerichtete CAR-T-Zell-Therapien zu teils langanhaltenden kombinierten Störungen der zellulären und humoralen Immunität und erhöhen dadurch auch langfristig das Risiko schwerer Infektionen (Rejeski et al. 2023, Wang et al. 2021).
Inklusive lymphodepletierender Therapie sind die Patienten damit zumeist für 15 bis 20 Tage in stationärer Betreuung. Anschließend erfolgt eine strukturierte Nachsorge am CAR-T-Zell-Therapiezentrum und durch die betreuenden Hämatologen.
Während die Gewinnung der autologen Zellen und die Gabe der CAR-T-Zellen an den hierfür qualifizierten Kliniken durchgeführt wird, erfolgt die eigentliche Herstellung durch pharmazeutische Unternehmen (siehe Abbildung 1, S. 15). Die Produktion ist aufwendig und das CAR-T-Zellprodukt entsprechend kostenintensiv. Angesichts dieses logistisch und auch arzneimittelrechtlich komplexen Ablaufs, werden die Zentren durch die herstellenden Firmen qualifiziert. Zugleich müssen die Zentren die Vorgaben des Gemeinsamen Bundesausschusses (G-BA) erfüllen, um eine Vergütung für die Kosten der Gesamtbehandlung (aktuell ca. 250 – 300T €) zu erhalten.
Zusammenfassend besteht die Herausforderung bei der CAR-T-Zell-Therapie neben der Logistik der Herstellung und dem Management der Nebenwirkungen vor allem im frühzeitigen Erkennen der Patienten mit absehbarer Indikation zur CAR-T-Zell-Therapie und der entsprechenden Abstimmung zwischen behandelnden Hämatologen und CAR-T-Zell-Therapiezentrum.
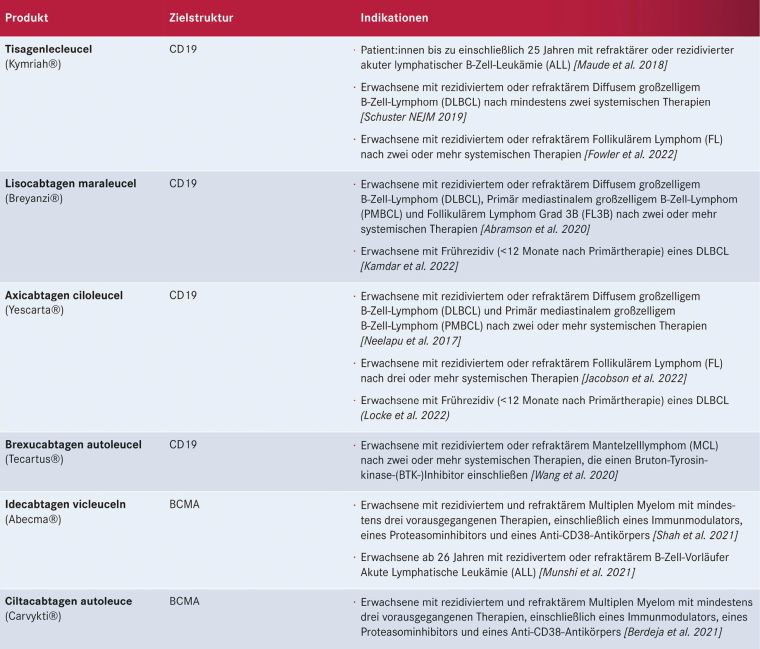
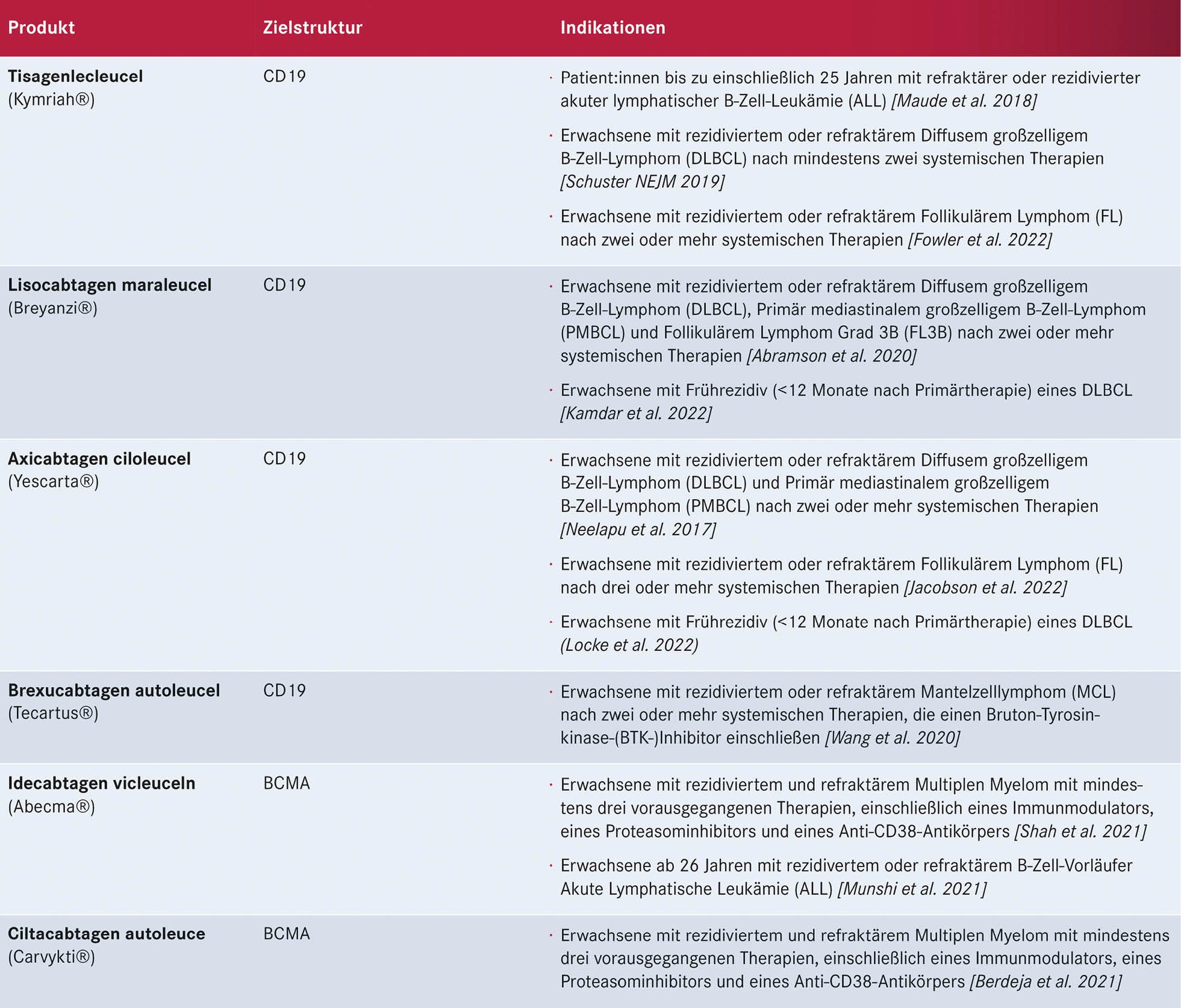
Tabelle 2: Aktuell für die Behandlung von Lymphomen in Deutschland zugelassene CAR-T-Zell-Therapien mit Zielantigen und Indikationen
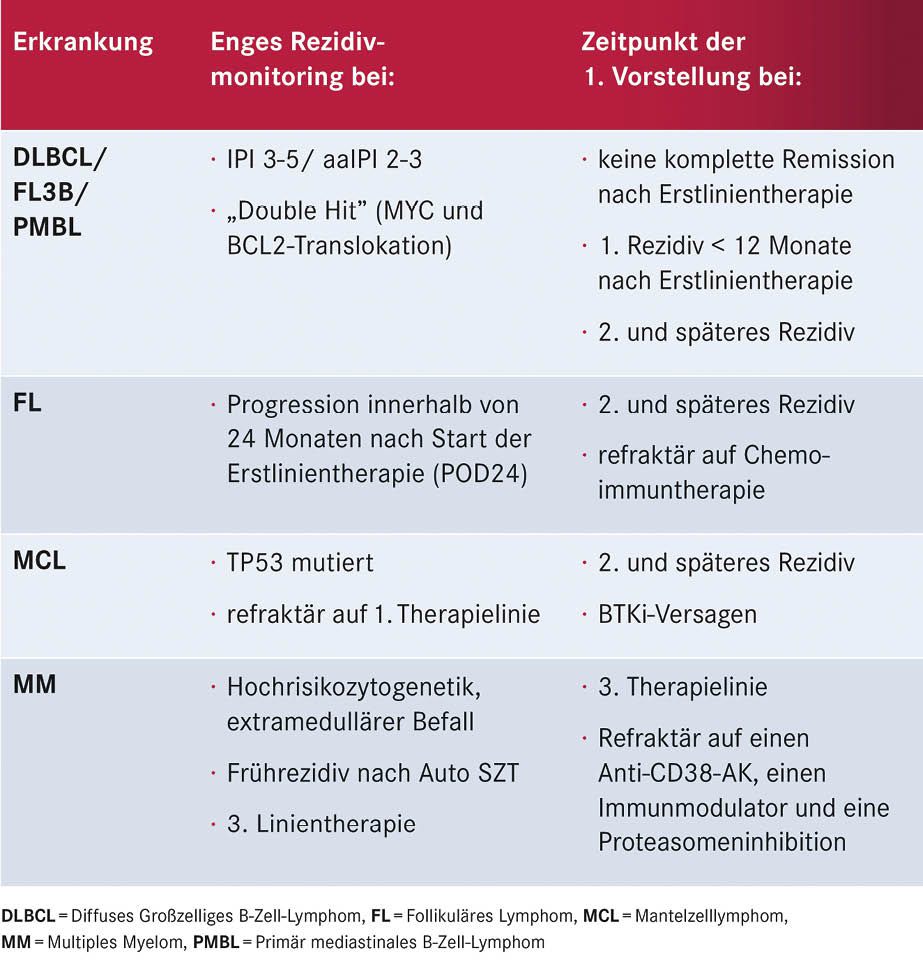
Tabelle 3: Ausgewählte Kriterien, die für eine perspektivisch indizierte CAR-T-Zell-Therapie und eine frühzeitige Vorstellung im CAR-T-Zell-Zentrum sprechen
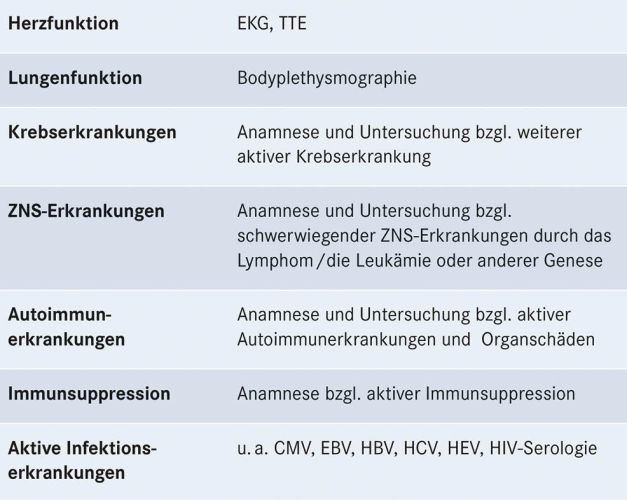
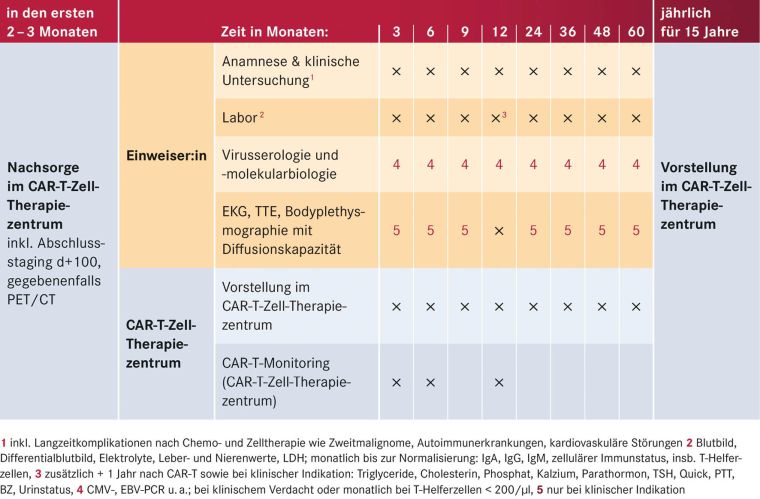
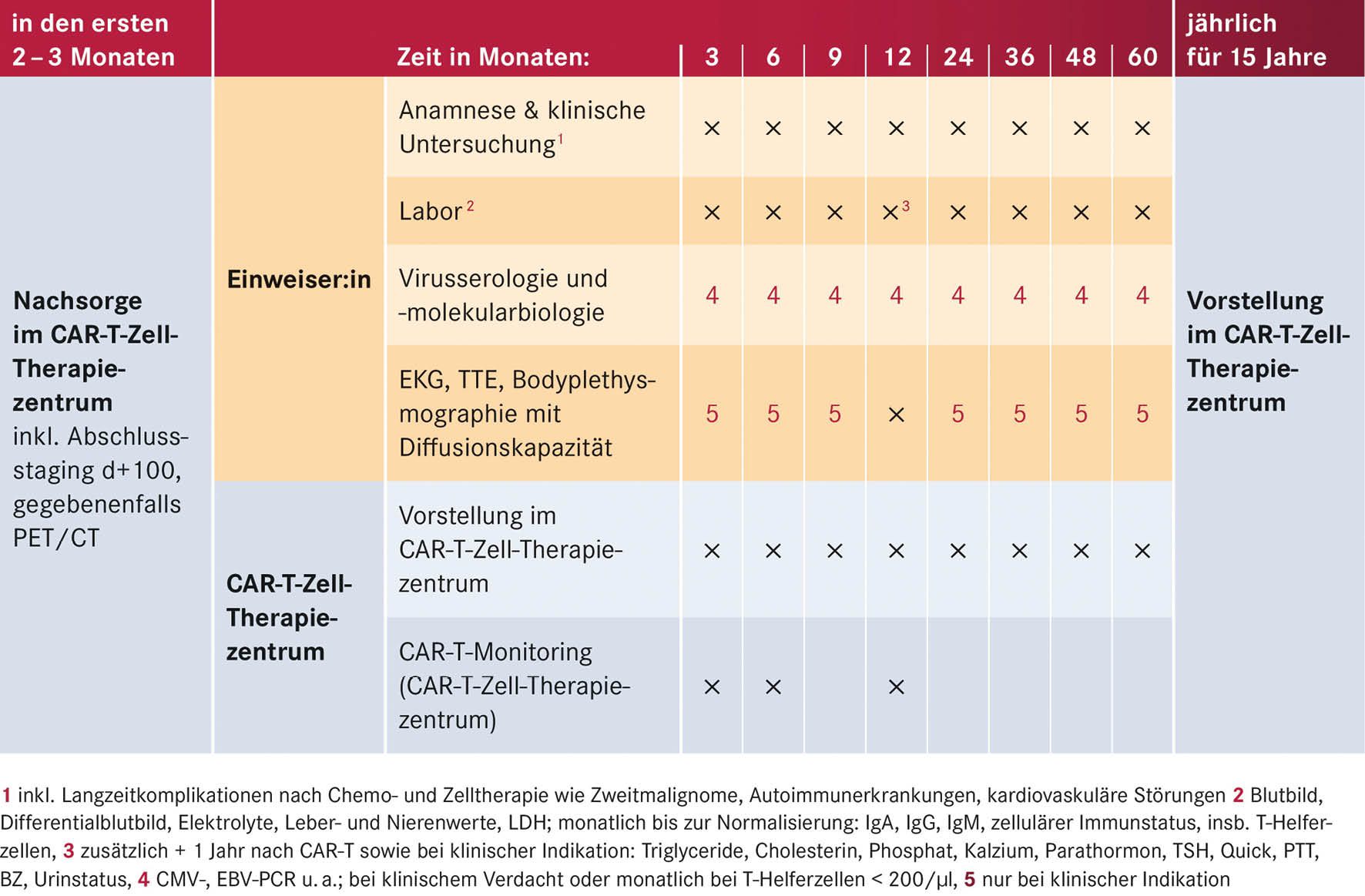
Tabelle 4: Ausgewählte Voruntersuchungen vor CAR-T-Zell-Therapie, gegebenenfalls weitere patientenindividuelle Untersuchungen
Aktuell sind in Deutschland die in Tabelle 2 (S. 17) dargestellten sechs CAR-T-Zell-Produkte zugelassen. Für jedes dieser Produkte muss das jeweilige Zentrum eine spezifische Qualifizierung durch den jeweiligen Hersteller durchlaufen. So sind am Universitätsklinikum Halle (Saale) fünf dieser Produkte verfügbar (Breyanzi®, Yescarta®, Kymriah®, Tecartus®, Abecma®). Damit stehen für alle, derzeit mit zugelassenen CAR-T-Zellprodukten behandelbaren Indikationen – Diffus großzelliges B-NHL, Akute Lymphatische Leukämie, Follikuläres Lymphom, Mantelzelllymphom, Multiples Myelom – CAR-T-Zellprodukte in Sachsen-Anhalt zur Verfügung.
Mit Remissionsraten von bis zu 80 % stehen mit den CAR-T-Zellen insbesondere für refraktäre und rezidivierte Lymphomerkrankungen neue effektive Therapielinien zur Verfügung. Weitere Indikationen zur CAR-T-Zell-Therapie werden erwartet. Außerhalb dieser Indikationen kann gegebenenfalls in Abstimmung mit dem CAR-T-Zell-Therapiezentrum und Antragstellung auf Kostenübernahme bei den Kostenträgern eine Therapie mit CAR-T-Zellen erfolgreich durchgeführt werden.
Zur optimalen Planung einer CAR-T-Zell-Therapie ist die frühe Vorstellung im CAR-T-Zell-Therapiezentrum wichtig, da der Prozess bis zur Applikation einige Wochen bis Monate benötigen kann. Bestimmte Kriterien helfen, an Lymphomen erkrankte Patienten frühzeitig für eine perspektivisch in Frage kommende CAR-T-Zell-Therapie zu identifizieren (siehe Tabelle 3, S. 17). Um die CAR-T-Zell-Gabe optimal auf den Therapieplan der Patienten abzustimmen, muss im weiteren Verlauf eine enge Abstimmung zwischen primären Behandelnden und CAR-T-Zell-Therapiezentrum erfolgen. Die in Tabelle 4 (S. 17) aufgeführten Voruntersuchungen vor CAR-T-Zell-Therapie sind notwendig zur Patientenauswahl und Therapiesteuerung und erfolgen in Abstimmung von primären Behandelnden und dem CAR-T-Zell-Therapiezentrum.
Wichtig ist, dass auch Patienten, die nicht für eine allogene Blutstammzelltransplantation geeignet sind, von einer CAR-T-Zell-Therapie profitieren können, da diese in der Regel mit deutlich geringeren akuten und Langzeitnebenwirkungen behaftet ist (siehe Abbildung 2).
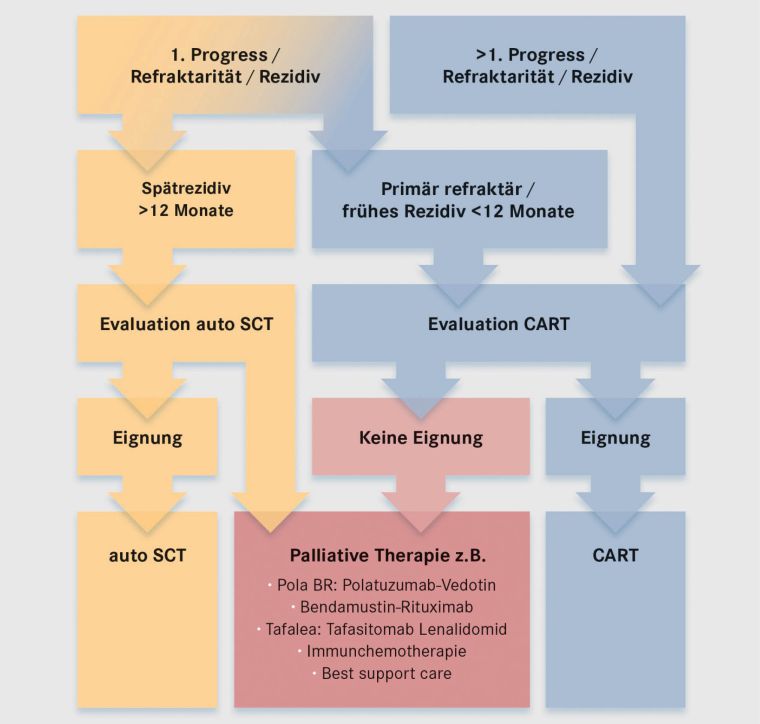
Abbildung 2: Indikationen zur CAR-T-Zell-Therapie bei Patienten mit großzelligen B-zelligen-Lymphomen (LBCL); umfasst Diffuses Großzelliges B-Zell-Lymphom mit allen Subtypen, hochgradige B-Zell-Lymphome (HGBCL), nicht anderweitig spezifiziert (NOS) oder mit MYC und BCL2 und /oder BCL6 Translokation, primär mediastinale B-Zell-Lymphome (PMBCL), follikuläre Lymphome WHO Grad 3B (FL3B) und transformierte indolente Lymphome (tFL)
Ziel der Nachsorge ist die frühzeitige Erkennung und Therapie von Komplikationen der CAR-T-Zell-Therapie wie Infektionen und Toxizitäten sowie eines eventuellen Progresses/Rezidivs der Grunderkrankung. Darüber hinaus soll die zeitnahe Dokumentation des Krankheitsstatus und möglicher Komplikationen gesichert werden. Häufige Komplikationen nach CAR-T-Zell-Therapie sind:
- Cytokine-Release-Syndrom (CRS)
- Neurotoxizität (Immune-Effector-Cell-associated-Neurotoxicity-Syndrome, ICANS)
- Hämatotoxizität (Immune effector cell–associated hematotoxicity, ICAHT)
- Hypogammaglobulinämie
- Infektionen mit bekapselten Erregern und Viren
- febrile Neutropenie, Sepsis (Rejeski et al. 2023, Yakoub-Agha et al. 2020)
Nach der CAR-T-Zell-Gabe verbleiben die Patienten zunächst für mindestens zehn Tage in stationärer Behandlung. Anschließend erfolgt während der ersten 100 Tage nach CAR-T-Zell-Infusion die Nachsorge über die Ambulanz des CAR-T-Zell-Zentrums. Dabei ist im ersten Monat eine Vorstellung mindestens einmal pro Woche, bis Tag +100 meist einmal alle zwei Wochen notwendig. Die weitere Betreuung erfolgt je nach klinischem Bedarf und notwendigen Staging-Untersuchungen in Zusammenarbeit mit den zuweisenden ambulanten Hämatoonkologen (siehe Tabelle 5) (Bonifant et al. 2016).
Nachsorge und Staging der hämatologisch-onkologischen Grunderkrankung erfolgen nach den erkrankungsspezifischen Empfehlungen. In der Regel sollten alle Patienten 1, 3, 6 und 12 Monate nach ihrer CAR-T-Zell-Infusion ein Restaging ihrer vorbekannten Erkrankungsmanifestationen mittels Bildgebung (CT, MRT oder PET-CT) sowie gegebenenfalls einer Knochenmarkpunktion erhalten. Die Erreichbarkeit des CAR-T-Zell-Therapiezentrums innerhalb von zwei Stunden muss im ersten Monat nach Therapie gewährleistet sein. Allen Patienten wird bei Entlassung ein produktspezifischer Patientenpass ausgehändigt, in dem die wichtigsten Therapieinformationen, das Verhalten beim Auftreten von Komplikationen und Notfallnummern vermerkt sind.
Die möglichen Langzeitkomplikationen entsprechen den Komplikationen nach Chemo- und Zelltherapie wie Zweitmalignome, Autoimmunerkrankungen und kardiovaskuläre Störungen. Ambulante (Krebs-)vorsorgeuntersuchungen sollten leitliniengerecht durchgeführt werden. Impfungen können in Rücksprache mit dem CAR-T-Zell-Therapiezentrum in individueller Abwägung analog der aktuellen AGIHO-Empfehlungen für Patienten nach autologer SZT durchgeführt werden (Hayden et al. 2022).
Korrespondierende Autorin:
Dr. Judith Schaffrath
E-Mail:
Universitätsklinik für Innere Medizin Halle IV,
Hämatologie/Onkologie; Universitätsmedizin Halle
Ernst-Grube-Straße 40
06120 Halle
Tabellen/Grafiken: atelier42, Halle (Saale)
Literatur
Abramson JS, Palomba ML, et al. Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet 2020; 396:839
Berdeja, Jesus G, et al. Ciltacabtagene autoleucel, a B-cell maturation antigen-directed chimeric antigen receptor T-cell therapy in patients with relapsed or refractory multiple myeloma. Lancet 2021; 398: 314
Bonifant CL, Jackson HJ, et al. Toxicity and management in CAR-T-cell therapy. Mol Ther Oncolytics 2016; 3:16011
Dean EA, Mhaskar RS, et al. High metabolic tumor volume is associated with decreased efficacy of axicabtagene ciloleucel in large b-cell lymphoma. Blood Adv 2020; 4(14):3268–76.
Fowler NH, Dickinson M, et al. Tisagenlecleucel in adult relapsed or refractory follicular lymphoma: the phase 2 ELARA trial. Nat Med. 2022; 28:325
Hayden PJ, Roddie C, et al. Management of adults and children receiving CAR T-cell therapy: 2021 best practice recommendations of the European Society for Blood and Marrow Transplantation (EBMT) and the Joint Accreditation Committee of ISCT and EBMT (JACIE) and the European Haematology Association (EHA). Ann Oncol. 2022; 33(3):259-275.
Jacobson CA, Chavez JC, et al. Axicabtagene ciloleucel in relapsed or refractory indolent non-Hodgkin lymphoma (ZUMA-5): a single-arm, multicentre, phase 2 trial. Lancet Oncol. 2022; 23:91
Kamdar M, Solomon SR, et al. Lisocabtagene maraleucel versus standard of care with salvage chemo- therapy followed by autologous stem cell transplantation as second-line treatment in patients with relapsed or refractory large B-cell lymphoma (TRANSFORM): results from an interim analysis of an open-label, randomised, phase 3 trial. Lancet 2022; 399:2294
Kochenderfer JN, Dudley ME, et al. Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor. J Clin Oncol. 2015; 33(6):540-9.
Korell F, Laier S, et al. Current Challenges in Providing Good Leukapheresis Products for Manufacturing of CAR-T Cells for Patients with Relapsed/Refractory NHL or ALL. Cells. 2020; 9(5):1225.
Locke FL, Miklos DB, et al. Axicabtagene Ciloleucel as Second-Line Therapy for Large B-Cell Lymphoma. NEJM 2022; 386:640
Maude SL, Laetsch, TW, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. NEJM 2018;378:439
Munshi, Nikhil C, et al. Idecabtagene Vicleucel in Relapsed and Refractory Multiple Myeloma. NEJM 2021; 384:705
Neelapu SS, Locke FL, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. NEJM 2017; 377:2531
Rejeski K, Subklewe M, et al. Immune effector cell-associated hematotoxicity: EHA/EBMT consensus grading and best practice recommendations. Blood 2023; 142(10):865-877
Schuster SJ, Bishop MR, et al. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. NEJM 2019; 380:45
Shah BD, Ghobadi A, et al. KTE-X19 for Relapsed or Refractory adult B-Cell Acute Lymphoblastic Leukemia. Lancet 2021; 398:491
Vercellino L, Di Blasi R, et al. Predictive factors of early progression after CAR T-cell therapy in relapsed/refractory diffuse large b-cell lymphoma. Blood Adv 2020; 4(22):5607
Wang M, Munoz J, et al. KTE-X19 CAR T-Cell Therapy in Relapsed or Refractory Mantle-Cell Lymphoma. NEJM 2020; 382:1331
Wang Y, Li C, et al. Humoral immune reconstitution after anti-BCMA CAR T-cell therapy in relapsed/refractory multiple myeloma. Blood Adv. 2021; 5(23):5290-5299.
Yacoub-Agha, I, Chabannon C, et al. Management of adults and children undergoing chimeric antigen receptor T-cell therapy: best practice recommendations of the European Society for Blood and Marrow Transplantation (EBMT) and the Joint Accreditation Committee of ISCT and EBMT (JACIE). Haematologica 2020;105:297